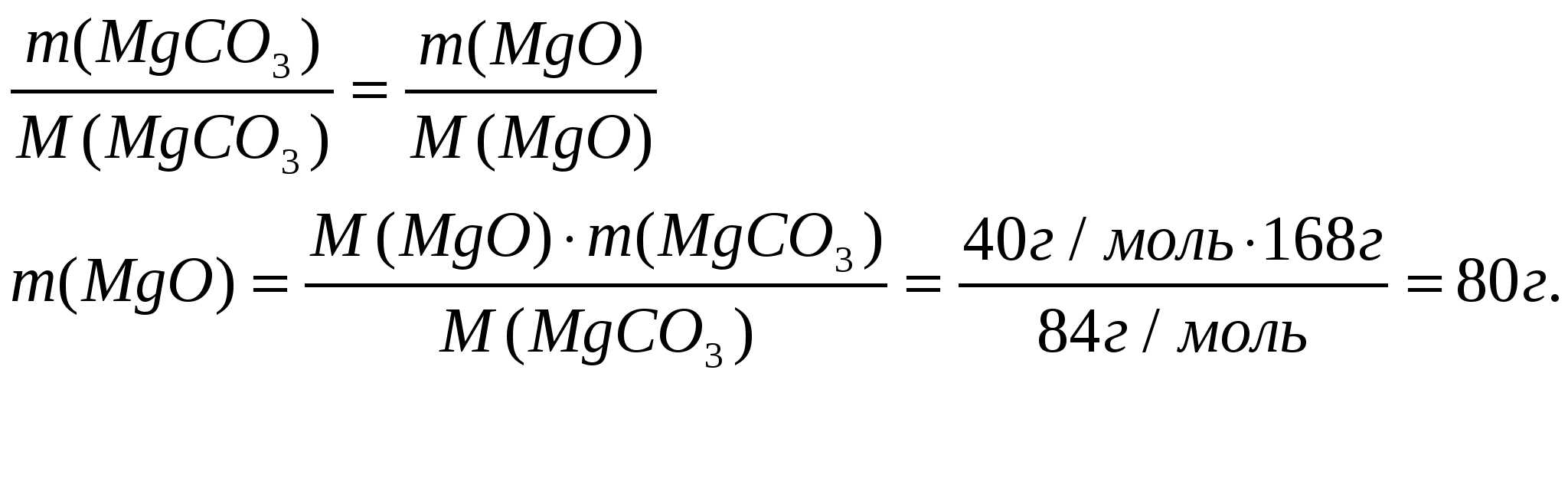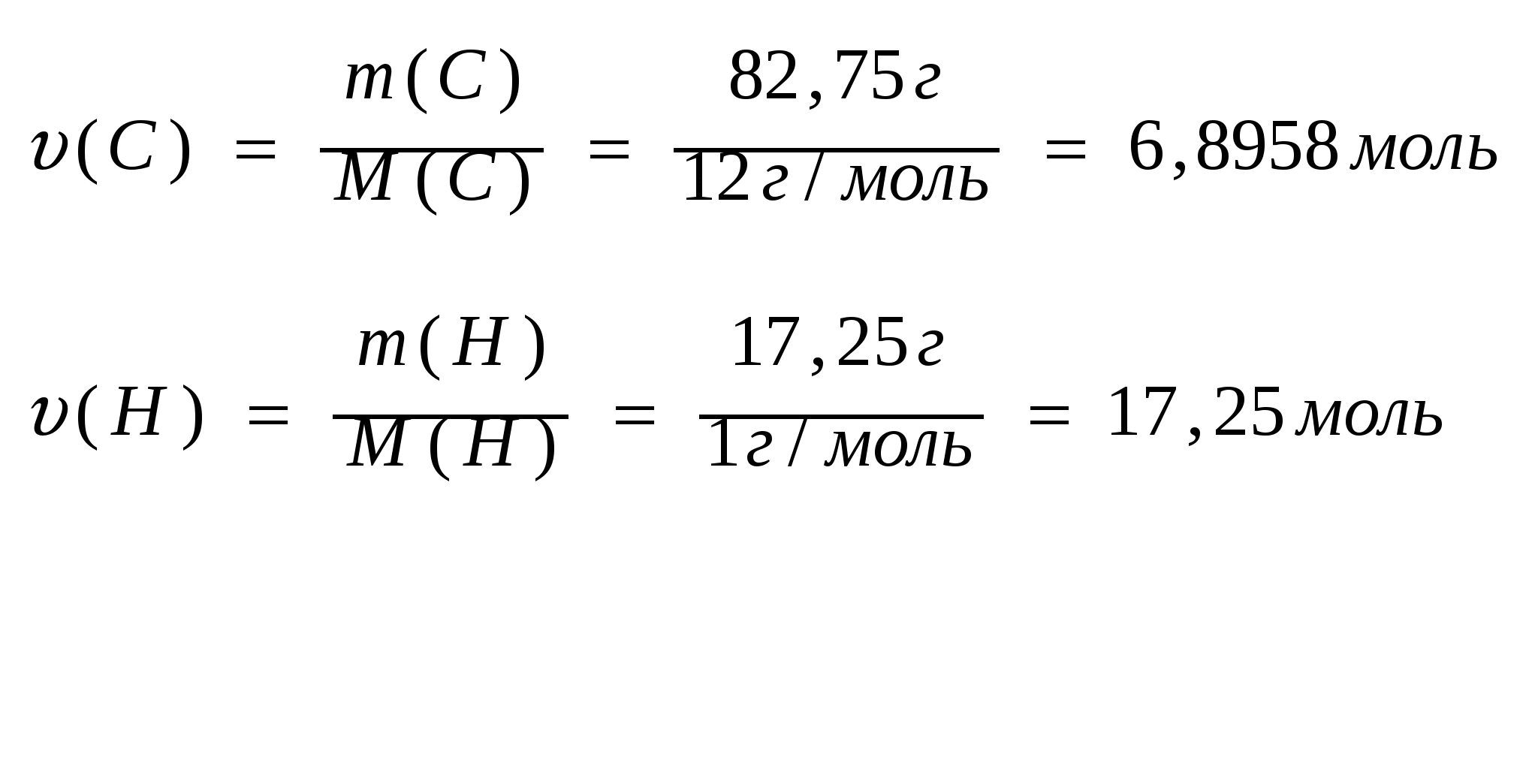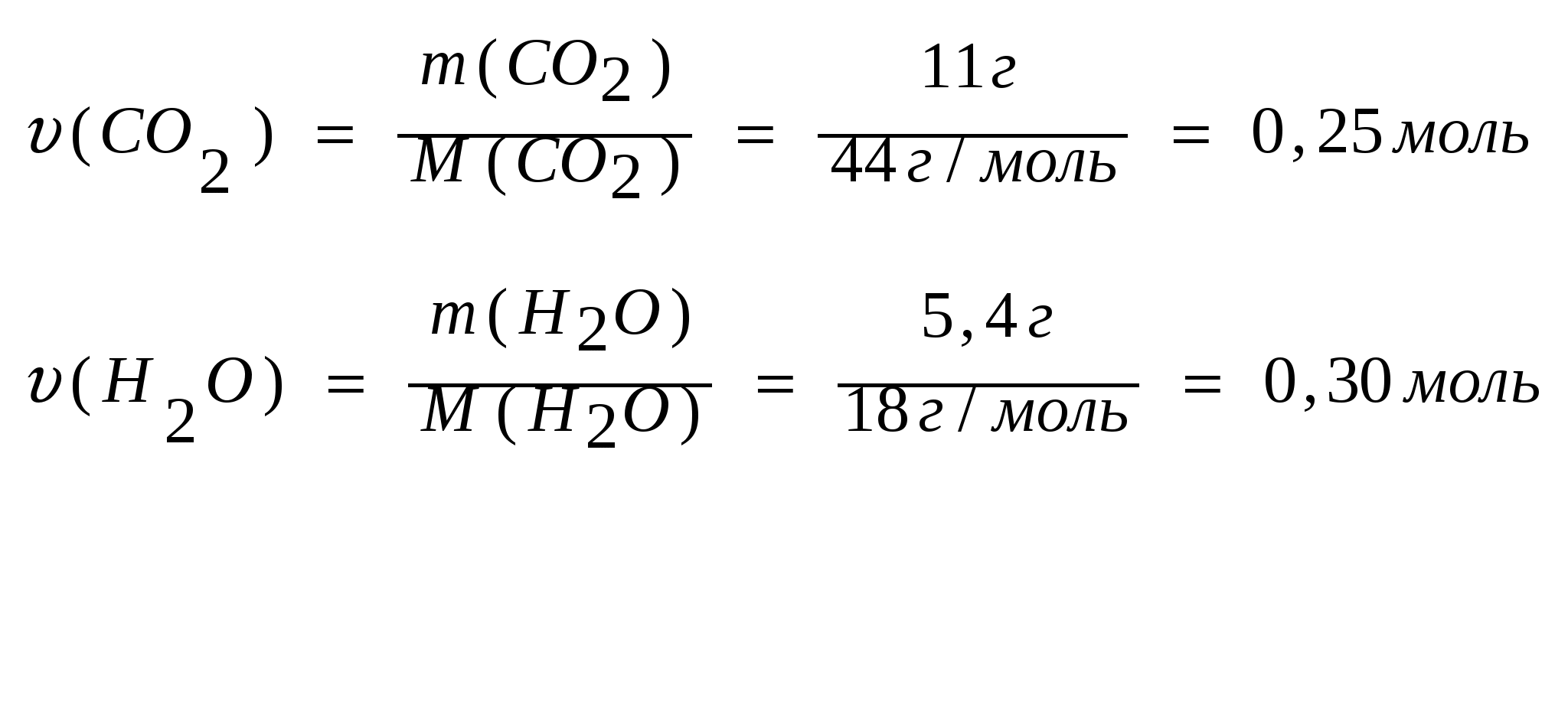|
Срок сдачи: две календарные недели после выдачи задания.
Средства диагностики проведенной самостоятельной работы:
1. Решение задач.
2. Тесты ЕГЭ по теме гидролиз и процессы в растворах. Задания группы B:
В1. Установите соответствие между названием соли и средой ее водного раствора.
НАЗВАНИЕ СРЕДА
СОЛИ РАСТВОРА
A) гидросульфид калия 1) нейтральная
Б) гидросульфит натрия 2) кислая
B) ортофосфат калия 3) щелочная
Г) хлорид хрома (III)
B2. Установите соответствие между названием coли и средой ее водного раствора.
НАЗВАНИЕ СОЛИ СРЕДА РАСТВОРА
A) гидрокарбонат калия 1) нейтральная
Б) гидрофосфат натрия 2) кислая
B) ортофосфат цезия 3) щелочная
Г) дигидрофосфат натрия
Таблица 4 – Эталоны ответов на тесты группы Б:
Задание B:
|
Ответ (последовательность четырех цифр)
|
B 1
|
|
B 2
|
|
2.8.Тема 8. Решение задач. Неорганические и органические классы веществ.
Методические рекомендации. Методические материалы представлены решенными задачами по различным классам веществ. Студенту необходимо ознакомиться с решенными задачами. Постарайтесь разобраться в решениях задач. При возникновении затруднений при разборе решений обратитесь к преподавателю. В справочных материалах представлены качественные и количественные задачи определения веществ.
Справочные материалы.
Задача №1. Определить массу оксида магния, которая образуется при разложении 168г. карбоната магния.
Дано:
m(MgCO3)=168 г.
|
Решение:
MgCO3 → MgO + CO2
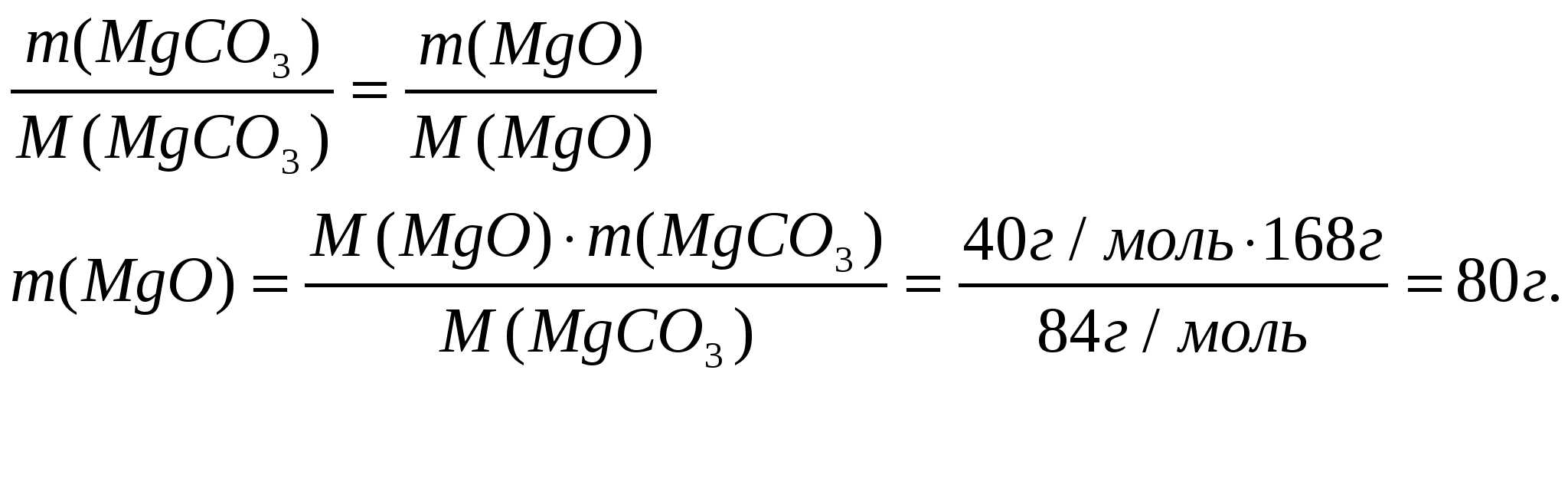
|
m(MgO)=?
|
Ответ: m(MgO)=80 г.
Задача №2. Определите с помощью характерных реакций каждое из трех предложенных неорганических веществ:
А) азотная кислота;
Б) гидроксид натрия;
В) хлорид алюминия.
Решение:
Вещества
|
Характерные качественные реакции
|
Азотная кислота
|
Азотная кислота + метиловый оранжевый (индикатор)=красное окрашивание
|
Гидроксид натрия
|
Гидроксид натрия + фенолфталеин (индикатор) = красное окрашивание раствора.
|
Хлорид алюминия
|
AlCl3 + 3NaOH = Al(OH)3↓+NaCl (молекулярное уравнение)
Al(OH)3 – студенистый осадок
Al3++3OH-= Al(OH)3↓ (сокращенное ионное уравнение)
|
Задача №3. Вычислите массу сульфата меди (II) если в реакцию с серной кислотой вступило 0,8 моль оксида меди (II).
Дано:
m(CuO)=0,8 моль.
|
Решение:
MgCO3 → CuSO4 +CO2
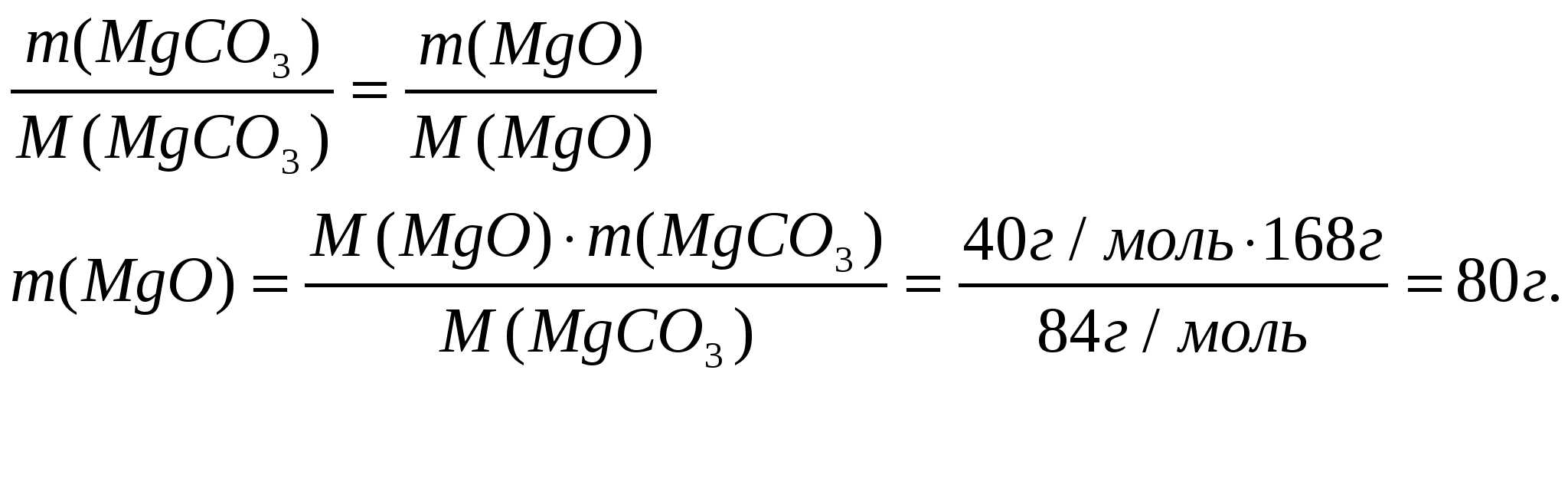
Ответ: масса оксида магния 80 грамм.
|
m(CuSO4)=?
|
Задача №4. Определите с помощью характерных реакций каждое из трех предложенных органических веществ:
А) пропионовая кислота;
Б) белок;
В) крахмал.
Решение:
Вещества
|
Характерные качественные реакции
|
Пропионовая кислота
|
Пропионовая кислота + метиловый оранжевый (индикатор) = раствор окрашивается в красный цвет
|
Белок (куриный белок)
|
Ксантопротеиновая качественная реакция
К 1 мл белка + 0,2 – 0,3 мл НNO3 (нагревают) = раствор мутнеет, а через 1-2 минуты раствор окрашивается в ярко-желтый цвет.
|
Крахмал
|
Крахмал + спиртовой раствор йода = раствор приобретает фиолетовый цвет
|
Задача №5. Какой объем хлора понадобится для реакции взаимодействия с этиленом, чтобы получить 46 литров дихлорэтана при н.у.
Дано:
V(C2H4Cl2)= 46 литра
|
Решение:
C2H4 + Cl2 = C2H4Cl2 (1,2-дихлорэтан)
Количества веществ равны:
υ(C2H4Cl2) = υ(Cl2 ).
Из равенства количеств получаем выражение:
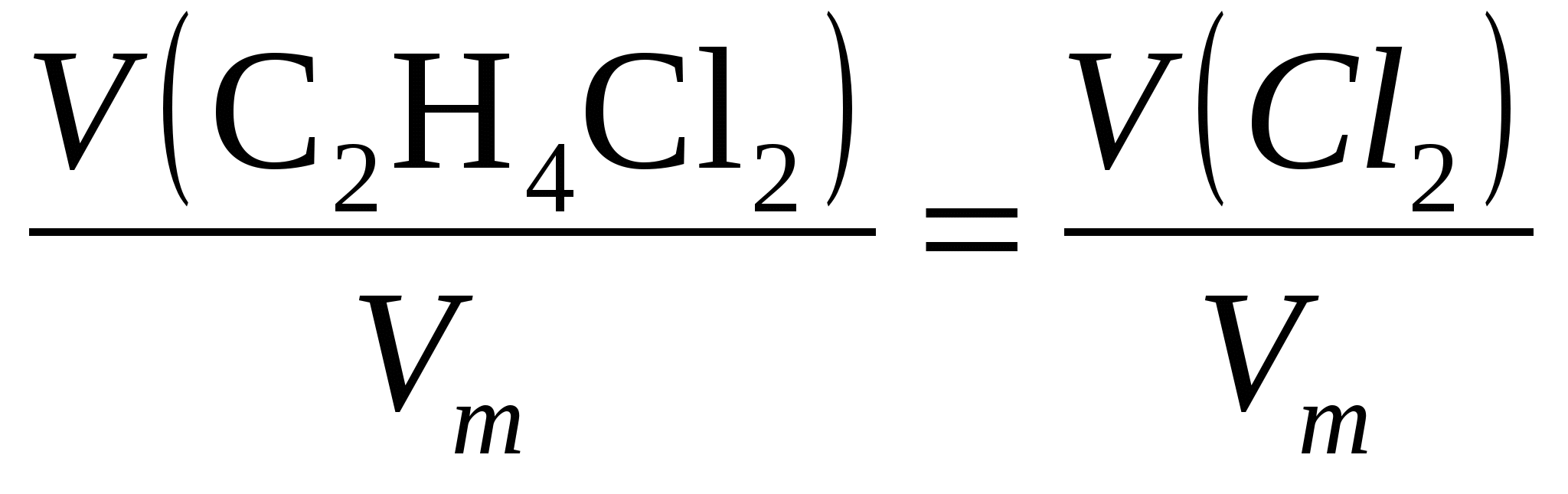 . .
Отсюда следует, что объемы равны. Объем хлора равен объему 1,2-дихлорэтана
V(C2H4Cl2) =V(Cl2)=46 литров
|
V(Cl2 )=?
|
Ответ: объем хлора 46 литров
Опыт №1. Проведите реакции, подтверждающие характерные химические свойства кислот.
Решение:
Реагирующие вещества
|
Характерные реакции
|
Металл + кислота
|
Na + HCl=NaCl+H2↑
|
Основание + кислота
|
NaOH + HCl = NaCl + H2O
|
Кислота + индикатор
|
Метиловый оранжевый (индикатор) + кислота = раствор приобретает красный цвет
|
Задача №6. Определить массу карбоната кальция, которая образуется при взаимодействии 5 моль оксида кальция с углекислым газом.
Дано:
υ (CaO) = 5 моль
|
Решение:
CaO + CO2 = CaCO3 (карбонат кальция)
Количества веществ равны:
υ(CaO) = υ(CaCO3)=5 моль.
Из равенства количеств получаем выражение:
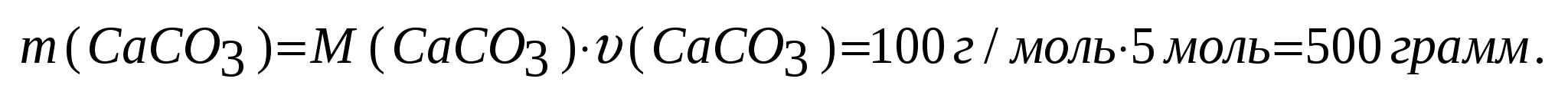 Ответ: масса карбоната кальция равна 500 грамм. Ответ: масса карбоната кальция равна 500 грамм.
|
m(CaCO3 ) =?
|
Опыт и задача №2. Получите гидроксид аммония, по уравнению реакции, определите массы хлорида аммония и гидроксида натрия, который необходим для получения 20 г гидроксида аммония.
Дано:
m (NH4OH) = 20 грамм
|
Решение:
NH4Cl + NaOH = NaCl + NH3↑ +H2O
NH3+H2O = NH4OH (гидроксид аммония)
1. Количество гидроксида аммония равно:
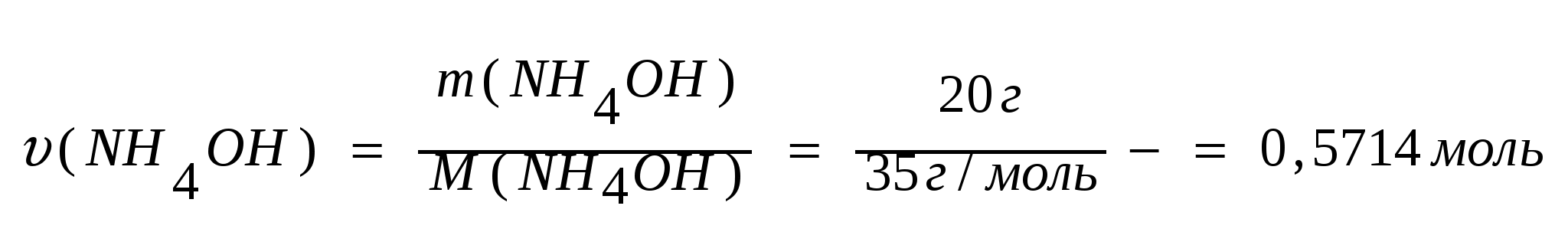
2. Из уравнений следует равенство количеств в соответствии со стехиометрическими коэффициентами и индексами
υ(NH4OH)=υ(NH4Cl)= υ(NaOH)=0,5714 моль
3. Рассчитаем необходимую массу гидроксида натрия для реакции:
m(NaOH)=M(NaOH)· υ(NaOH) = 40 г/моль·0,5714 моль=22,85 г.
4. Рассчитаем необходимую массу хлорида аммония для получения гидроксида аммония:
m(NH4Cl) = M(NH4Cl) · υ(NH4Cl)=50,5 г/моль· 0,5714моль = 28,8 г.
|
m(NH4Cl ) =?, m(NaOH) =?
|
Ответ: m(NaOH) = 22,85 г., m(NH4Cl)=28,8 г.
Задача №7. Какая масса нитрата калия получится, если к 11,2 г гидроксида калия добавили 13 г. азотной кислоты.
Дано:
m (КOH) = 11,2 грамм;
m(HNO3) = 13 грамм
|
Решение:
KOH + HNO3 = KNO3 +H2O
1. Рассчитаем количества вещества гидроксида калия и азотной кислоты:
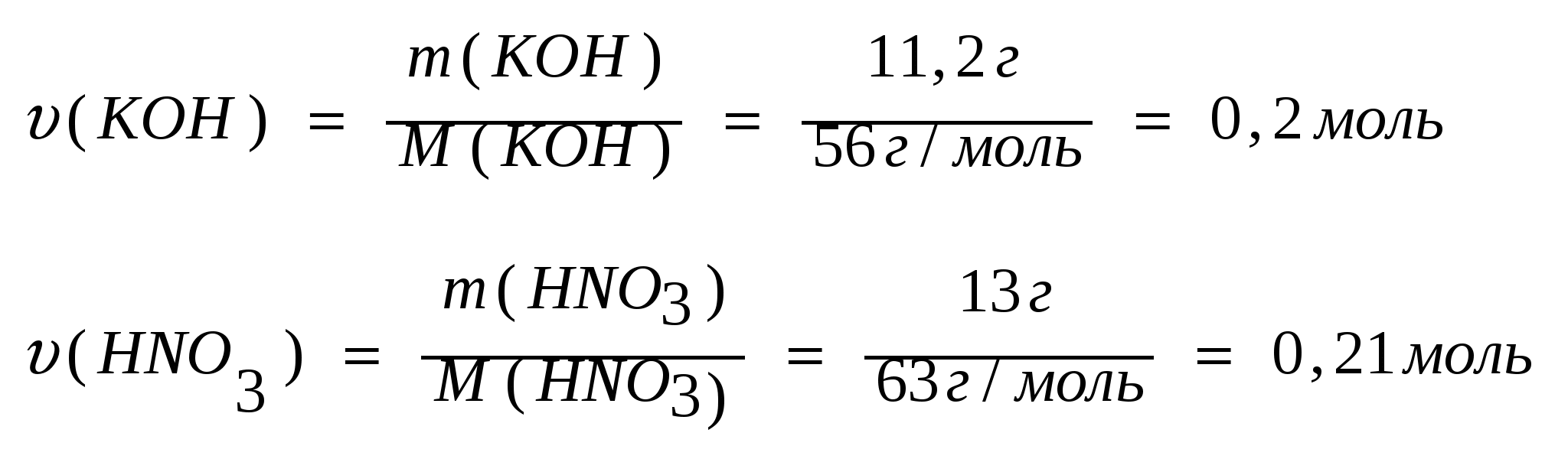
Из расчетов мы видим, что в недостатке гидроксид калия, значит расчет массы продукта реакции - нитрата калия производим по количеству гидроксида калия
υ (KOH) =υ(KNO3 )=0,2 моль
2. Расчет массы нитрата калия:
m(КNO3) = M(KNO3)· υ(KNO3 )= 101 г/моль·0,2 моля =20,2 г
Ответ: m(КNO3)=20,2 грамма.
|
m(КNO3)=?
|
Опыт №3. Проведите реакции, подтверждающие химические свойства уксусной кислоты.
Решение:
Вещества
|
Характерные качественные реакции
|
Уксусная кислота
|
Уксусная кислота + метиловый оранжевый (индикатор) = раствор окрашивается в красный цвет
|
Уксусная кислота
|
СаСO3 + 2HCl=CaCl2 + CO2↑+H2O?
наблюдается бурное выделение углекислого газа.
|
Задача №8. Выведите молекулярную формулу углеводорода, содержащего 82,75% углерода и 17,25% водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
W%(C)= 82,75%;
W%(H) = 17,25%
|
Решение:
1. Рассчитаем молярную массу определяемого углеводорода:
M(Cx Нy) = Dвоздуху·M(воздуха)=2·29=58 г/моль.
2. Найдем молярную массу углеводорода СxHy:
M(СxHy) = M(C) ·x+M(H) ·y=58, получим выражение
12·x+1·y=58 (а).
3.Пусть масса углеводорода равна 100 грамма, то получим массы углерода и водорода, содержащиеся в углеводороде:
m(C)= m(СxHy) ·W%(C)/100 =100г·82,75%/100=82,75 г.
m(H)= m(СxHy) ·W%(H)/100 =100г·17,25%/100=17,25 г.
4. Найдем количества углерода и водорода в углеводороде:
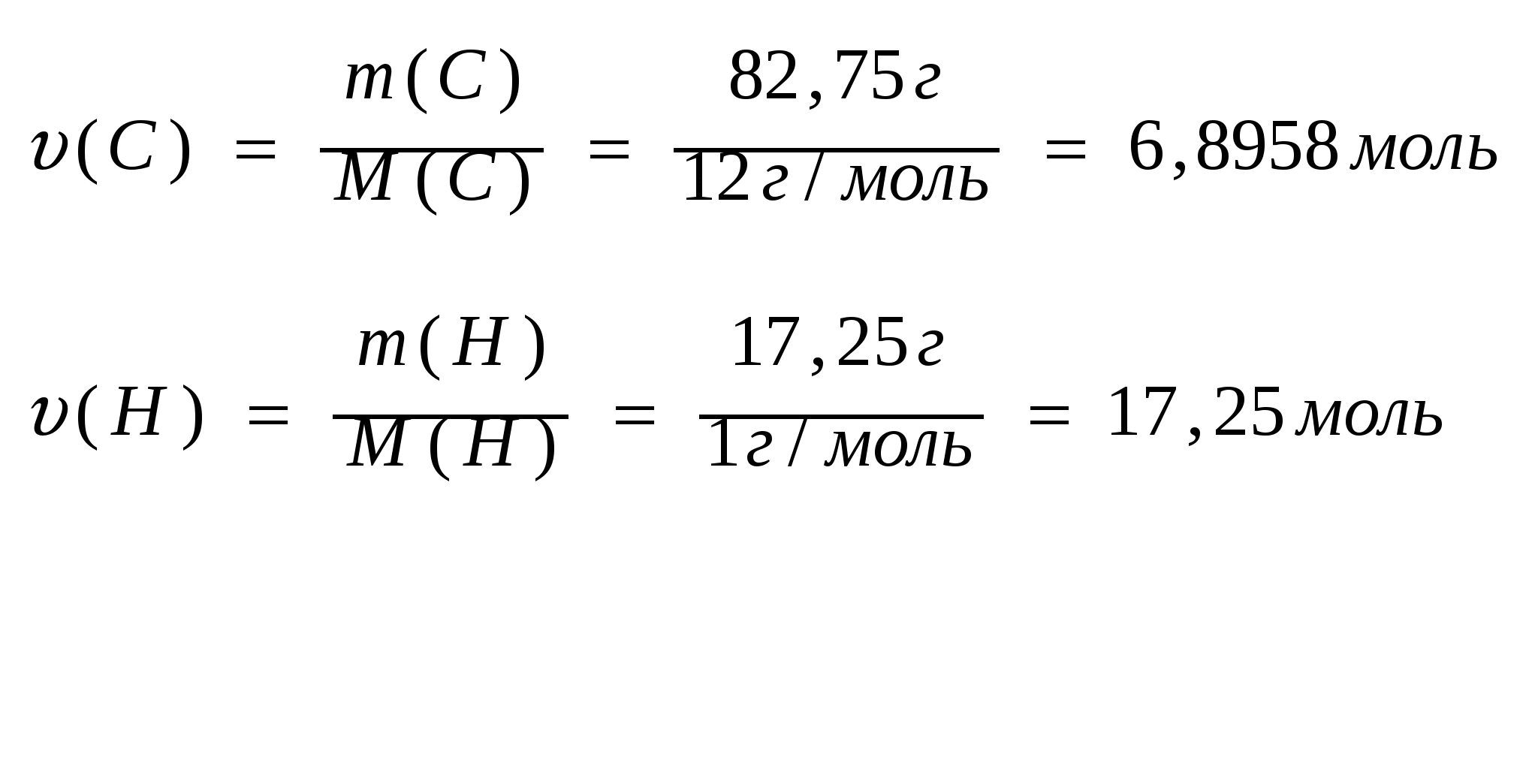
5. Найдем соотношение количеств веществ водорода и углерода:
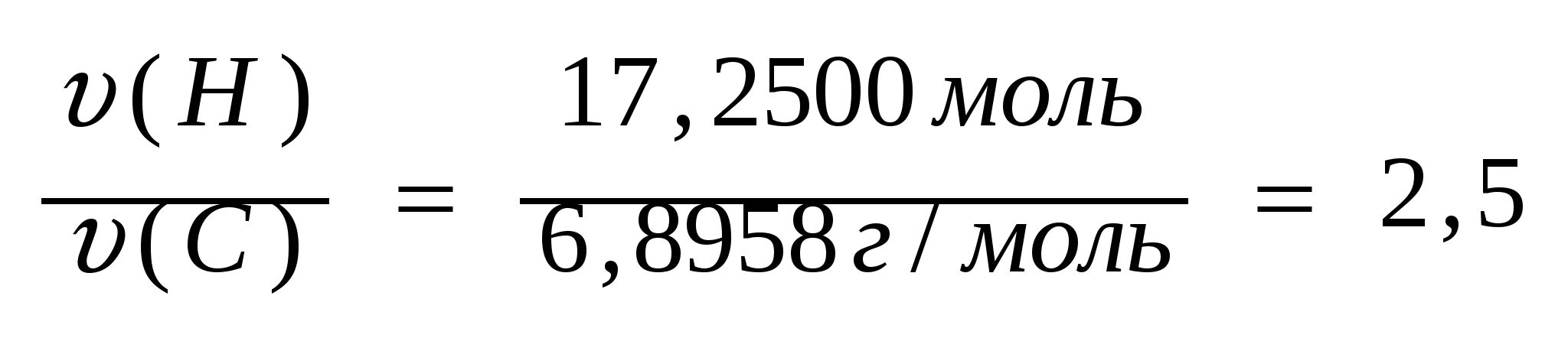 . .
6. Отношение количеств веществ углерода и водорода равны
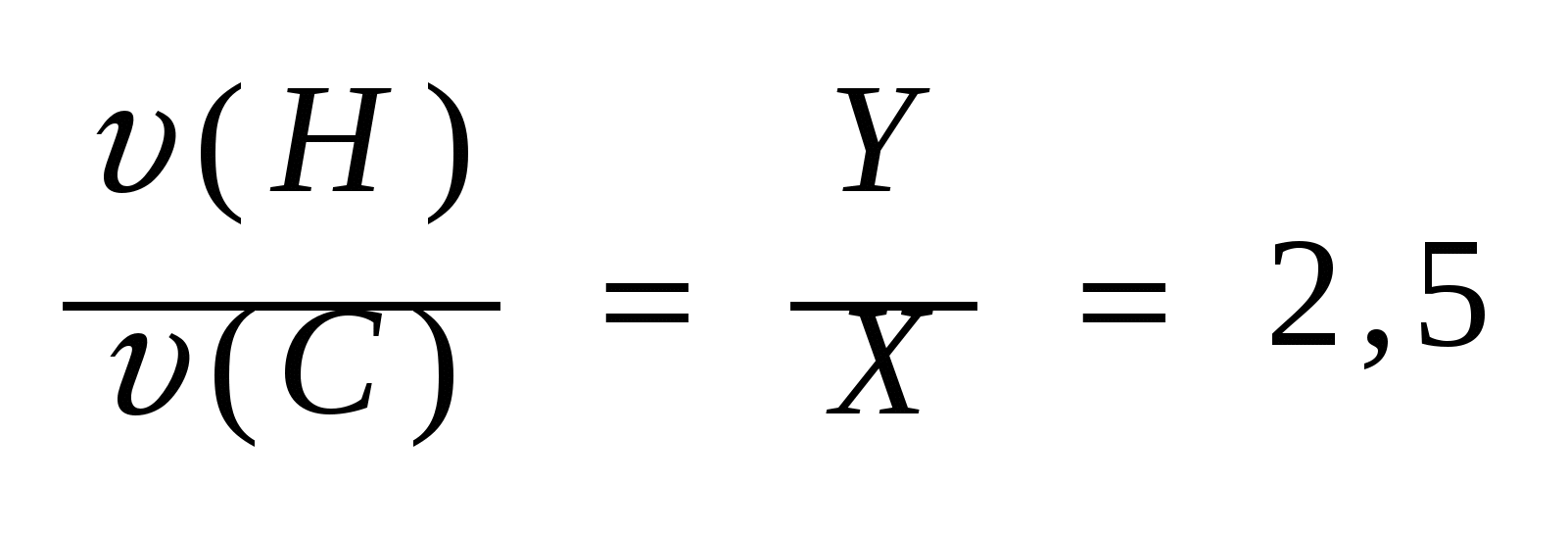 (б). (б).
Из выражений (а) и (б) составим систему уравнений:
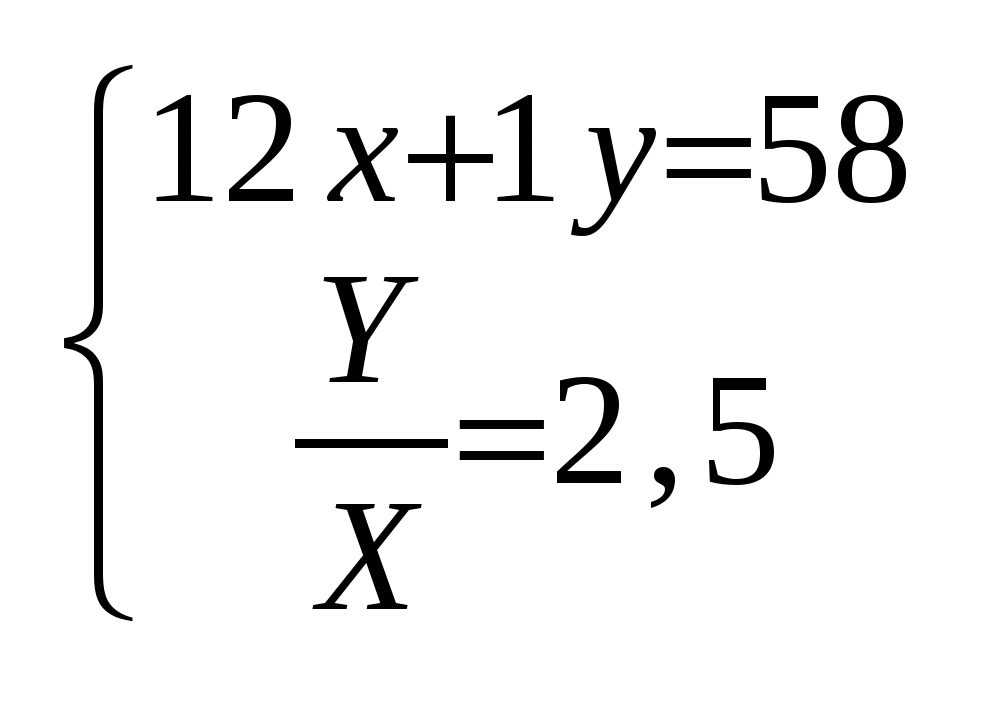
Решая полученную систему уравнений любым из методов, найдем значения, x и y:
x=4 , y=10.
Ответ: углеводород С4 H10 (бутан).
|
Определить формулу: СxHy
|
Задача №9. При сгорании 3,6 г. углеводорода образовалось 11г. оксида углерода (IV) и 5,4 г. воды. Относительная плотность паров этого вещества по водороду равна 36. Определите молекулярную формулу этого вещества.
Дано:
m(СxHy)= 3,6 грамм
m(CO2) = 11 грамм;
m(Н2O) = 5,4 грамм;
|
Решение:
При сгорании углеводорода образуются вещества:
Cx Нy + O2 = CO2 + Н2О
1. Найдем количества углекислого газа и воды, которые получены в результате сгорания в углеводорода:
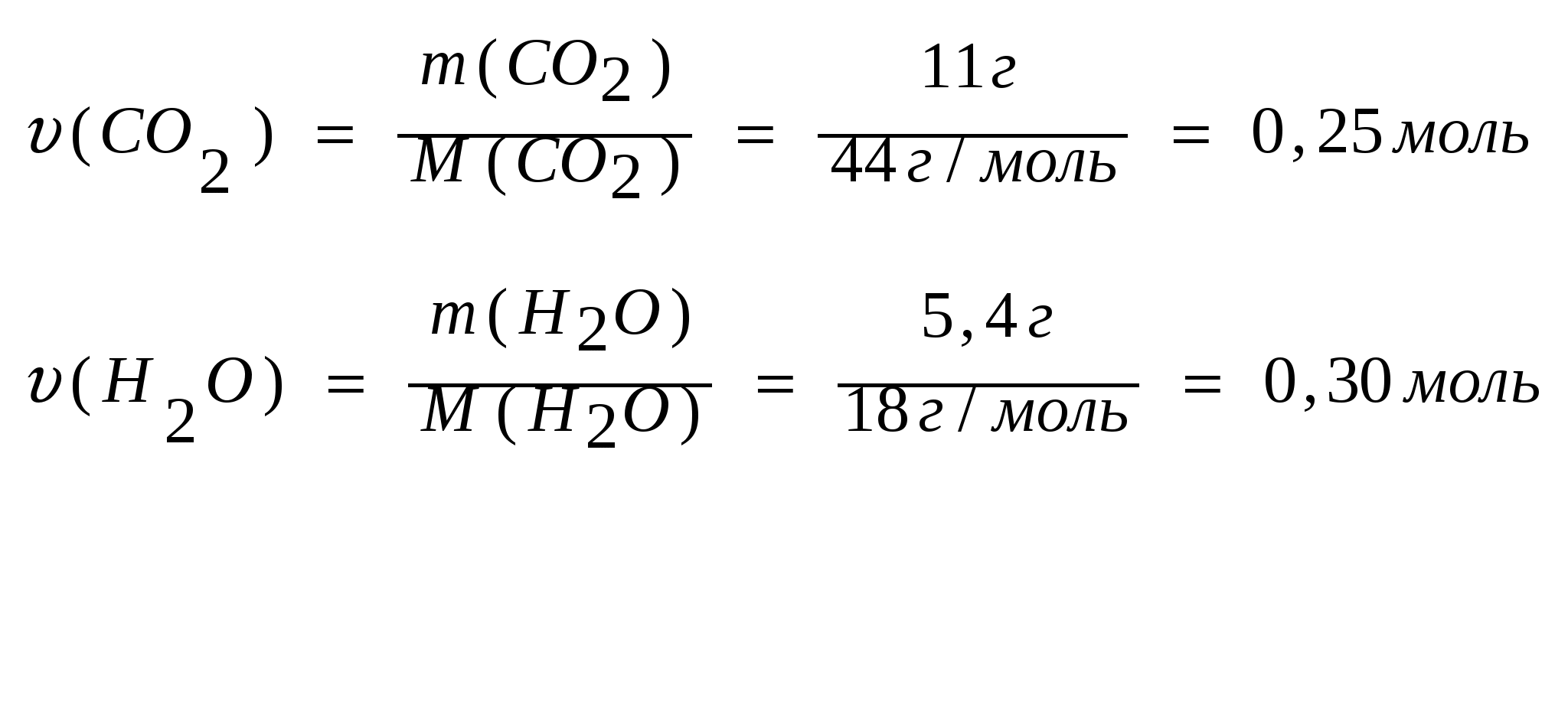
2. Найдем количества веществ водорода и углерода, в образующихся продуктах реакции горения:
υ(С) = υ (СO2) = 0,25 моль
υ(Н) = 2· υ (H2O )=2·0,30 моль = 0,6 моль
3. Для проверки найдем массы углерода и водорода, сумма этих масс должна совпасть с массой заданного углеводорода, в противном случае необходимо определять еще один элемент:
m(C)=M(C) ·υ(С) =12г/моль·0,25 моль=3 г.
m(H)= M(H) · υ(Н)=1г/моль·0,6моль =0,6 г.
Сумма массы углерода и водорода равна 3,6г., значит других элементов в углеводороде нет.
4.Найдем отношение количеств углерода и водорода:
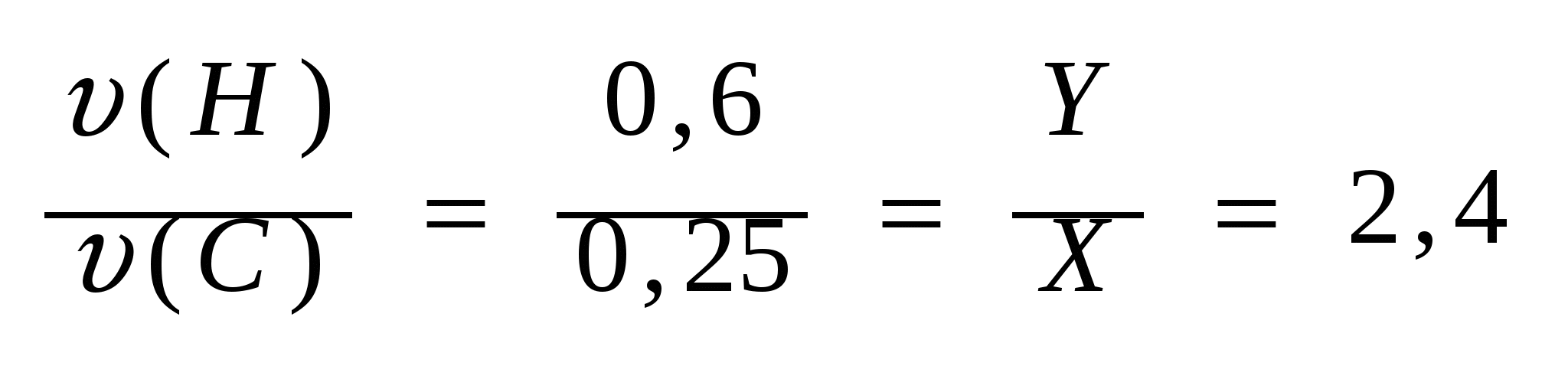 (а). (а).
5. Найдем соотношение X и Y:
Умножение на:
|
С
|
H
|
|
X
|
Y
|
1
|
X
|
2,4X
|
5
|
5
|
12
|
Получим С5H12 – пентан.
Ответ: углеводород С5H12 – пентан.
|
Определить формулу: СxHy
|
Опыт №4. Проведите реакции, подтверждающие качественный состав сульфата меди(II).
Решение:
Вещества
|
Характерные качественные реакции сульфата меди (II)
|
Качественная реакция на катион меди
|
СuSO4+2NaOH=Cu(OH)2↓(осадок голубого цвета) + Na2SO4
|
Качественная на сульфат анион
|
CuSO4+BaCl2=BaSO4↓(осадок белого цвета)+СuCl2
|
Задача №10. Определите количество вещества кремния полученного восстановлением 24г. оксида кремния (IV) алюминием, массовая доля примесей в котором 4%.
Дано:
mтехн(SiO2) = 24 грамма;
W%(SiO2) = 96%
|
Решение:
SiO2 + C = CO2 +Si(кр)
1. Найдем массу оксида кремния беспримесей:
m(SiO2)= mтехн(SiO2)∙ W%(SiO2)/100=24г·96%/100=23,04г.
2. Рассчитаем количество вещества оксида кремния:
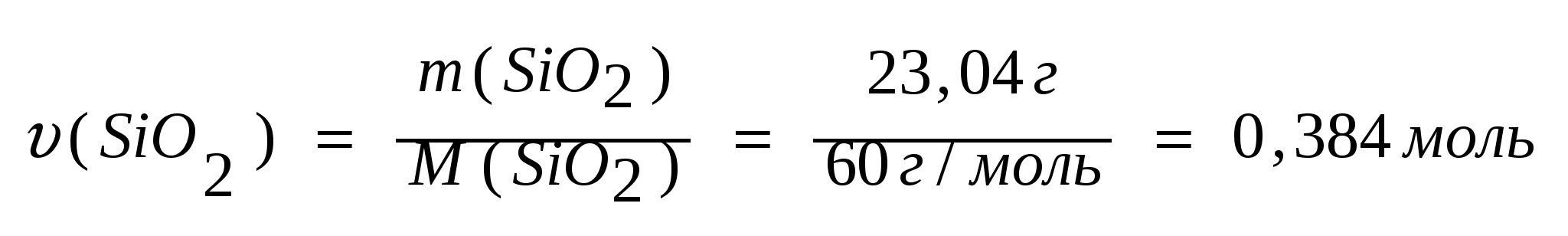 3. Количество кремния и оксида кремния равны: 3. Количество кремния и оксида кремния равны:
υ (SiO2) =υ(Si )=0,384 моль
Ответ: количество кремния υ(Si )=0,384 моль.
|
υ (Si)=?
|
Опыт №5. Испытайте лакмусом растворы солей CuSO4 и K2CO3. Объясните результаты наблюдений.
Соли
|
Реакции гидролиза солей
|
CuSO4
|
2CuSO4 + 2HOH↔(CuOH)2SO4 +H2SO4 (молекулярное уравнение)
2Cu2++2SO42-+ 2HOH↔ 2(CuOH)+ +SO42- + 2H++SO42- (полное ионное уравнение)
Cu2++ HOH↔ (CuOH)++ H+ (сокращенное ионное уравнение).
(среда кислая, раствор лакмуса приобретает красный цвет)
|
K2CO3
|
K2CO3 + HOH↔КHCO3+KOH (молекулярное уравнение)
2K++CO32-+ HOH↔К++ HCO3-+K++ OH- (полное ионное уравнение)
CO32-+ HOH↔ HCO3-+ OH- (сокращенное ионное уравнение)
(среда щелочная, раствор лакмуса приобретает фиолетовый цвет)
| |
|
|
 Скачать 0.91 Mb.
Скачать 0.91 Mb.