Т. М. Мальгина (руководитель группы), директор, к п. н., доцент, заслуженный учитель РФ
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
| Задача №11. К 150 г. 10% раствора нитрата серебра прибавили раствор хлорида натрия. Вычислите массу образовавшегося осадка.
Опыт №6. Получите амфотерный гидроксид цинка и проведите реакции, характеризующие его свойства.
Задача №12. Какой объем водорода, который образовался при взаимодействии 60г. цинка с соляной кислотой (при н.у.).
Опыт №7. Определите принадлежность глицерина к классу многоатомных спиртов. Решение: Приготовим раствор гидроксида меди (II), который прибавим к глицерину, в результате образуется комплексное соединение фиолетового цвета: 1. CuSO4 + 2NaOH→ Cu(OH)2↓(осадок голубого цвета) + Na2SO4 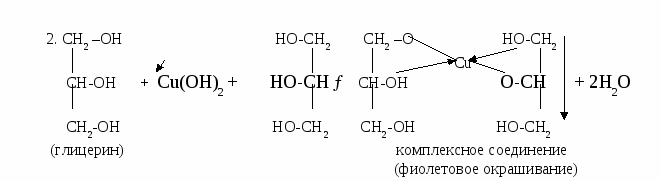 Задача №13. При полном сжигании 42 литров метана (н.у.) выделилось 1674 кДж теплоты. Определите тепловой эффект химической реакции.
Задача №14. Определите с помощью характерных реакций каждое из трех предложенных неорганических веществ: А) Хлорид железа (III); Б) Хлорид алюминия; В) Сульфат меди (II). Решение:
Опыт №8. Проведите реакции, подтверждающие качественны состав сульфата цинка. Решение:
Опыт №9. Осуществите превращение CuSO4 Решение: 1. CuSO4+ 2NaOH→ Cu(OH)2↓+Na2 SO4 2. Cu(OH)2 =CuO+ H2O (при нагревании). Задача №15. При бромировании бензола получили 251,1 г. бромбензола, что составляет 80% от теоретического выхода. Вычислите массу бензола, вступившего в реакцию.
Опыт №10. Получите аммиак и проведите реакции, характеризующие его свойства. Решение: Аммиак (газообразное веществ) можно получить при нагревании хлорида аммония и кристаллов гидроксида натрия, выделяющийся аммиак изменяет цвет розовой лакмусовой бумаги на фиолетовый, что подтверждает основные свойства аммиака. Реакция получения аммиака: NH4Cl + NaOH = NH3↑+ NaCl+H2O. После ознакомления со справочными материалами преступаем к выполнению заданий, состоящие из задач. Задачи первого уровня самостоятельной деятельности: Ответьте на вопросы: 1. Что означает термин «задача»? 2. Чем отличаются качественные и количественные задачи? (найти примеры из дополнительной литературы или интернета) 3. Объясните, почему возможны различные способы решения химических задач? Ответы представьте письменно. Задачи второго уровня самостоятельной деятельности: Выполните задания: 1. Выпишите формулы, по которым были решены задачи. 2. На примерах двух решенных задач составьте алгоритм действий при её выполнении. 3. Предложите альтернативный способ решения двух решенных задач. Задачи третьего уровня самостоятельной деятельности: Выполните задания: 1. Найдите в интернете сайты, где предлагаются задачи с решениями, оформите ссылки в виде:
2. В задачах, которые решены в интернете, подставьте другие данные и решите эти задачи. Сделайте вывод о правильности решенной задачи. Задание четвертого уровня самостоятельной деятельности: Задачи необходимо представить с решениями. Задачи: 1. К 416 г 10% -ного раствора хлорида бария прилили избыток 14% -ного раствора соды. Осадок отфильтровали. Когда к фильтрату прибавили 438 г 5% -ного раствора соляной кислоты, выделение газа прекратилось. Определите массу раствора соды. Ответ: 378, 6 грамм. 2. К 100 мл 10,6%-ного раствора хлорида кальция (плотность 1,05 г/мл) добавлено 30 мл 38,55%-ного раствора карбоната натрия (плотность 1,10 г/мл). Определите массовые доли соединений, содержащихся в растворе после отделения осадка. Ответ: 1, 6 % карбоната натрия; 9,1% хлорида натрия. 3. Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20% -ной соляной кислоты (плотность 1,1 г/мл) на 4 г сульфида железа (II). Ответ: 7, 31% соляной кислоты; 19, 29% хлорида железа (II) 4. 300 г 5% -ного раствора гидроксида натрия нейтрализовали 8% -ной соляной кислотой. Какую массу воды нужно удалить из этого раствора, чтобы получить 20% -ный раствор поваренной соли? Ответ: 361,4 г.- воды. Задания пятого уровня самостоятельной деятельности. Задачи, которые представлены на пятом уровне, относятся к олимпиадным задач или задачам группы «С» Единого Государственного Экзамена. Задачи[1],[2]: 1. К 50 г 6%-ного раствора стеарата калия добавили 20 г 1% -ного раствора серной кислоты. Будет ли выделяться газ при добавлении карбоната натрия к отделенному водному раствору? Ответ подтвердите расчетами. Ответ: Не будет. 2. Какой объем 10% -ного раствора гидроксида калия (плотность 1,09 г/мл) потребуется для нейтрализации смеси, состоящей из 1 г уксусной кислоты и 1 г муравьиной кислоты? Ответ: 19,7 мл раствора гидроксида калия 3. При окислении 400 г водного раствора муравьиной кислоты аммиачным раствором оксида серебра образовалось 8,64 г осадка. Вычислите массовую долю кислоты в исходном растворе. Ответ: 0,46% - муравьиной кислоты. 4. 37 г неизвестной предельной одноосновной органической кислоты нейтрализовали водным раствором гидрокарбоната натрия. При пропускании выделившегося газа через известковую воду было получено 50 г осадка. Какая кислота была взята и каков объем выделившегося газа (н. у.)? Ответ: пропановая кислота, углекислый газ 11,2 литра. 5. При сплавлении натриевой соли одноосновной органической кислоты с гидроксидом натрия выделилось 11,2 л (н. у.) газообразного органического соединения, которое при нормальных условиях имеет плотность 1,965 г/л. Определите, сколько граммов соли вступило в реакцию и какой газ выделился. Ответ: 55 грамм натриевая соль бутановой кислоты, пропан. Литература: 1. Медведев, Ю.Н. ЕГЭ 2013. Химия. Типовые тестовые задания / Ю.Н. Медведев. –М .: Издательство «Экзамен», 2013. -159, с.ISBN 978-5-377-05522-8. 2. Хомченко Г.П. Сборник задач по химии для поступающих в вузы (с решениями) – М.: «Экзамен»-2012. 2.9.Тема 9. Составление рефератов и презентаций по химии Цель работ: формирование умений проводить исследовательскую работу по обобщению прочитанного материала Методические рекомендации. Составление рефератов и презентаций является одной из форм обобщения тематических материалов, что играет огромное значение для умения представить свой материал. В таблице 3 представлены темы, по которым необходимо составить рефераты и презентации.
Рефераты и презентации могут иметь различный уровень сложности и по-разному оцениваются преподавателем. Для этого студент сам выбирает уровень деятельности, то есть уровень выбора реферативного и презентационного задания. Задание первого уровня самостоятельной деятельности: Выполните задания по темам таблицы 3: 1. Соберите общие сведения по теме и оформите в виде реферата. 2. Общие сведения представьте в виде презентации. Задание второго уровня самостоятельной деятельности: 1. Соберите сведения по применению указанных веществ и процессов в вашей будущей профессии и оформите материал в виде реферата. 2. Материалы реферата представьте в виде презентации. Задание третьего уровня самостоятельной деятельности: 1. Собранный материал из различных источников по темам представьте на устной защите на одном из занятий. 2. Посетите высшие учебные заведения в рамках предметных недель для получения консультации по данным темам у ученых Оренбургского университетского учебного округа. Задание четвертого уровня самостоятельной деятельности: Подготовленный материалы презентации и реферата представляются на студенческой научной конференции в колледже имени А. С. Макаренко. Задание пятого уровня самостоятельной деятельности: На основе материалов рефератов и презентаций напишите тезисы для представления выбранной вами темы на всероссийских конференциях. Литература по химии для студентов и преподавателя
Приложение А – Тест № 1 на оценку способностей к саморазвитию, самообразованию студента 1. За что Вас ценят Ваши друзья? а) За то, что преданный и верный друг. б) Сильный и готов в трудную минуту за них постоять. в) Эрудированный, интересный собеседник. 2. На основе сравнительной самооценки выберите, какая характеристика Вам более всего подходит? а) Целеустремленный б) Трудолюбивый. в) Отзывчивый. 3. Как Вы относитесь к идее ведения личного ежедневника, к планированию своей работы на год, месяц, ближайшую неделю, день? а) Думаю, что чаще всего это пустая трата времени. б) Я пытался это делать, но не регулярно. в) Положительно, так как я давно это делаю. 4. Что Вам больше всего мешает профессионально самосовершенствоваться, лучше учиться? а) Нет достаточно времени. б) Нет подходящей литературы и условий. в) Не всегда хватает силы воли и настойчивости. 5. Каковы типичные причины Ваших ошибок и промахов? а) Невнимательный. б) Переоцениваю свои способности. в) Точно не знаю. 6. На основе сравнительной самооценки выберите, какая характеристика Вам более всего подходит? а) Настойчивый. б) Усидчивый. в) Доброжелательный. 7. На основе сравнительной оценки выберите, какая характеристика Вам более всего подходит? а) Решительный. б) Любознательный. в) Справедливый. 8. На основе сравнительной самооценки выберите, какая характеристика Вам более всего подходит? а) Генератор идей. б) Критик. в) Организатор. |