Задача Предложите формулу спирта, молярная масса которого в 2 раза превышает молярную массу самого лёгкого углеводорода (1 балл)
 Скачать 402.16 Kb. Скачать 402.16 Kb.
|
| Разновидности заданий С5 в ЕГЭ по химии. Важнейшие расчетные формулы. Задача 1. Предложите формулу спирта, молярная масса которого в 2 раза превышает молярную массу самого лёгкого углеводорода (1 балл). Самый лёгкий углеводород – метан, его М = 16 г/моль, значит, М(спирта) = 32 г/моль. Это метанол СН3OН Задача 2. Предложите формулы двух неорганических веществ, плотность которых равна плотности пропана (1 балл). Если равны плотности, то равны и молярные массы веществ. Причем, вещества эти должны быть газообразными при н.у. М (пропана) = 44 г/моль. Такую же молярную массу имеют углекислый газ СО2 и веселящий газ N2O. Задача 3. Предложите формулы 4 газообразных веществ, молярная масса которых равна 28 г/моль (2 балла). Ответ СО, С2Н4, N2 , газ – диборан (B2H6). «тяжелый» ацетилен – C2D2, вместо атомов протия (изотопа водорода с массовым числом 1) в его молекуле присутствуют атомы дейтерия (изотопа водорода с массовым числом 2) Задача 4. Установите структурную формулу сложного эфира, плотность паров которого по воздуху равна плотности паров по воздуху уксусной кислоты (1 балл). Равенство плотности паров по воздуху говорит о равенстве молярных масс. Сложный эфир имеет такой же состав, как уксусная кислота – это метилформиат. Задача 5*. Приведите структурную формулу углеводорода, газообразного при температуре ниже 20oC, молярная масса которого превышает молярную массу бутана (2 балла). это неопентан или диметилпропан Задача 6. Плотность газа при нормальных условиях равна 0,759 г/л. Определите его молярную массу и предложите формулу (1 балл). М=ρ·Vm; М(газа)= 0,759 г/л ·22,4 л/моль = 17 г/моль; Газ – аммиак NH3 Задача 7. Определите молярную массу углеводорода и предложите его молекулярную формулу, если известно, что при 100оС и при давлении 90 кПа его плотность составляет 2,903 г/л (2 балла). Из уравнения Менделеева – Клапейрона PV = (m/M) RT, выразим М: М = mRT / PV; m/V=ρ, следовательно: М = ρRT / P Переведем единицы измерения в СИ: ToК = 273 + 100oC = 373К; Р = 90000 Па; ρ = 2,903 кг/м3 Подставим данные в формулу М = 2,903∙ 8,314∙ 373/90000 = 0,100 кг/моль = 100 г/моль Допустим что это предельный углеводород СnH2n+2 M(СnH2n+2) = 14n+2 =100; n=7. Такому количеству атомов С и молярной массе соответствует С7Н16 Задача 8. Предложите формулы двух органических веществ, относительная плотность которых по воздуху 1,0345 (1 балл). M(вещества)= D возд · М(возд) = 1,0345·29=30 г/моль, соответствует веществам С2Н6 и НСОН Задача 9. 1,3 г некоторого углеводорода при 87оС и давлении 100 кПа занимают объем 0,5 л. Определите молярную массу углеводорода, предложите его молекулярную формулу (2 балла). Переведем данный объем в объем при н.у. с помощью объединенного газового закона: P0V0/T0 = PV/T; 101,324 ∙V0/273 = 100 ∙0,5/360; V0 = 0,374 л Полученное значение подставить в формулу: M = m ∙VM/V; М = 1,3 ∙22,4/0,374 = 78 г/моль; так как по условию известно что это углеводород, количество атомов С найдем 78/12 = 6, соответственно бензол С6Н6 Задача 10. При взаимодействии 2,9 г одноатомного спирта с избытком натрия выделилось 0,56 л водорода (н.у.). Установите молярную массу спирта. Предложите его молекулярную формулу и две структурных (2 балла). 2ROH + 2Na →2RONa + H2 n(H2)=V/Vm = 0,56/22,4=0,025 (моль) n(ROH)=2n(H2)= 2·0,025 = 0,05 (моль) М(ROH)=m/n = 2,9/0,05 = 58 г/моль М(R)=58-17=41 г/моль 41/12=3, т.о. С3Н5ОН этой формуле может соответствовать два спирта С 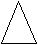  Н2=СН-СН2-ОН и ОН Н2=СН-СН2-ОН и ОНЗадача 11. Установите общую формулу тринитропроизводных бензола с предельными радикалами двумя способами (2 балла). 1 способ: изобразим структурную формулу представителя данного класса: например,  СН3 СН3   NO2 NO2 NO2 NO2 NO2 выведем молекулярную формулу: С7Н5(NO2)3 Если индекс при С, равный 7, принять за n, то индекс при водороде, равный 5, можно выразить как 2n-9, число нитрогрупп по условию равно 3. Следовательно, общая формула CnH2n-9(NО2)3 2 способ: из предельной формулы CnH2n+2 вычитаем 2·7 (из расчета того, что в молекуле 1 цикл, 3 π-связи в бензольном кольце, 3 π-связи в 3-х нитрогруппах) и в молекуле содержится 3 атома азота, на каждый из них прибавляем по 1 атому водорода. Таким образом, получаем CnH2n+2 -14 +3(NО2)3 или CnH2n-9(NО2)3. Задача 12. Плотность паров некоторого диаминоалкана по этану равна 2. Определите формулу диаминоалкана (2 балла). Расчитаем общую формулу диаминоалкана: CnH2n+2 ,. в молекуле нет циклов и π-связей, но есть два атома азота. На каждый атом азота прибавляем по 1 атому водорода. CnH2n+2+2 N2 Получаем CnH2n+4 N2 М(диаминоалкана)= D С2Н6 · М(С2Н6)=2·30 = 60 г/моль M(CnH2n+4 N2)=14n+ 4+28=14n+32 = 60, отсюда n=2 Формула диаминоалкана С2H8N2 Вывод формул на основании мольных и массовых долей химических элементов Задача 1. Мольные доли элементов в веществе составляют: 7,69% серебра; 23,08% азота; 46,15% водорода; 23,08% кислорода. Установите молекулярную формулу вещества, предположите его строение и дайте название. (2 балла) Решение: Пусть формула искомого вещества AgxNyHzОq, тогда х : y : z : q = χ(Ag) : χ(N) : χ(H) : χ(O) = 7,69 : 23,08 : 46,15 : 23,08 = 1 : 3 : 6 : 3., тогда состав AgN3H6O3 , соответствует формуле [Ag(NH3)2]NO3 нитрат диаминсеребра Задача 2. Определите простейшую формулу соединения, в котором массовые доли углерода, водорода и кислорода равны соответственно: 76,6%, 6,38% и 17,02% (2 балла). Решение: x : y : z = ω(C)/Ar(C) : ω(H)/Ar(H) : ω(O)/Ar(O) =76,6/12 : 6,38/1 : 17,02/16 = 6,38:6,38:1,06 = 6:6:1 С6Н6О,что соответствует С6Н5ОН - фенол Задача 3. Массовая доля кислорода в предельном трехатомном спирте равна 40%. Установите молекулярную формулу спирта (2 балла). Решение: Общая формула предельного трехатомного спирта – СnH 2n+2O3 Молярная масса кислорода = 16*3=48 г/моль составляет 40% Молярная масса СnH 2n+2 = 14n+2 г/моль составляет 100-40 = 60% Из пропорции 40(14n+2) = 2880, n=5, т.о. формула спирта С5Н9(ОН)3 Задача 4. Установите молекулярную формулу вещества, если массовые доли в нем углерода, водорода и кислорода равны соответственно: 57,83%; 3,61% и 38,55%. Молярная масса этого вещества в 2,862 раза больше, чем молярной массы бутана. Предложите одну структурную формулу этого соединения (2 балла) Решение: x : y : z = ω(C)/Ar(C) : ω(H)/Ar(H) : ω(O)/Ar(O) =57,83/12 : 3,61/1 : 38,55/16 = 4,82:3,61:2,41 = 2:1,5:1 = 4:3:2 т.о. простейшая формула С4Н3О2 М(С4Н3О2) = 83 г/моль М(в-ва)/М(прост. ф-лы)=166/83=2, следовательно простейшую формулу удваиваем : С8Н6О4 Такому составу удовлетворяет структурная ф-ла бензолдикарбоновой кислоты – фталевой, изофталевой или терефталевой Н  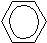  ООС СООН ООС СООНЗадача 5. Напишите структурные формулы трёх углеводородов, имеющих разную молярную массу, но одинаковую массовую долю углерода, равную 90% (3 балла). Р    ешение: Пусть масса углеводорода 100 г, тогда m(C)=90 г, m(H)=10 г, тогда n(C)=m/M=90/12=7,5 моль, n(Н)=m/M=10/1=10 моль. n(C): n(Н = 7,5:10=15:20 =3:4, т.о. условию задачи будут удовлетворять формула углеводорода С3Н4, С6Н8 , С9Н12 и т.д. С3Н7 ешение: Пусть масса углеводорода 100 г, тогда m(C)=90 г, m(H)=10 г, тогда n(C)=m/M=90/12=7,5 моль, n(Н)=m/M=10/1=10 моль. n(C): n(Н = 7,5:10=15:20 =3:4, т.о. условию задачи будут удовлетворять формула углеводорода С3Н4, С6Н8 , С9Н12 и т.д. С3Н7 СН3-С=СН СН3-С=СН Задача 6. Некоторый углеводород при действии избытка бромной воды образует тетерабромпроизводное, содержащее 75,8% брома по массе. При кипячении этого углеводорода с подкисленным серной кислотой раствором перманганата калия образуется только одна одноосновная карбоновая кислота. Определите структурную формулу исходного углеводорода (4 балла). Решение: Т .к. получается тетрабромпроизводное в молекуле углеводорода имелось две π- связи, формула тетрабромпроизводного CxHyBr4 ω(Br)=n·Ar(Br)/Mr (в-ва) 0,758 =80·4/ Mr (в-ва), отсюда Mr (CxHyBr4)=422, тогда М(CxHy)=422-320=102 г/моль. Прикинем число атомов углерода 102 : 12 = 8,5. Следовательно атомов углерода не более 8. 8х12=96, тогда атомов водорода = 102-96=6, такое малое количество водородов, а также тот факт, что при кипячении этого углеводорода с подкисленным серной кислотой раствором перманганата калия образуется только одна одноосновная карбоновая кислота может говорить о том, что это ароматический углеводород, с непредельным радикалом в котором две π- связи. Этому удовлетворяет формула С6Н5- С≡CH 5С6Н5- С≡CH + 8KMnO4 + 12H2SO4 →5C6H5COOH + 5CO2 + 4K2SO4 + 8 MnSO4 + 12H2O Задача 7. В результате обработки алкена водным раствором перманганата калия получено соединение, в котором массовая доля углерода на 47% меньше, чем исходном алкене. Установите формулу алкена и полученного из него соединения (4 балла). Решение: формула алкена СnH2n . В любом алкене ω(С) = 12n/14n = 6/7 = 85,7%, тогда в продукте ω(С) = 85,7 – 47 = 38,7%. Продуктом окисления алкена водным раствором перманганата калия является двухатомный спирт общая формула которого Сn H 2n+2O2 M(Сn)=12n соответствует 38,7% М(H 2n+2O2)=2n+2+32=2n+34 соответствует 100 – 38,7=61,3% Из пропорции 12n·61,3=38,7·(2n+34), n= 2, т.о. формула алкена С2Н4 – этилен, продукт СН2(ОН)-СН2(ОН)-этиленгликоль ИЛИ Можно было выразить массовые доли углерода в алкене (12n/14n) и гликоле (12n/(14n + 34)), их разность равна 0,47: (12n/14n) – (12n/(14n + 34)) = 0,47, n = 2. Задача 8. При нагревании природного дипептида с концентрированной соляной кислотой образовалось два продукта, массовая доля хлора в одном из них составила 28,29%. При реакции этого же пептида с разбавленной соляной кислотой образовался один продукт с массовой долей хлора 16,71%. Определите аминокислотный состав дипептида и напишите две возможные структурные формулы (4 балла). Решение: При нагревании природного дипептида с концентрированной соляной кислотой образуются соли аминокислот NH2-CHR/-CO-NH-CHR//-COOH +2HCl →2[NH3-CH(R)-COOH]Cl В одной из этих солей по условию массовая доля хлора 28,29%. Составим пропорцию: 28,29% - 35,5 100% - М(соли), отсюда М(соли)=125,5 г/моль, тогда М(R/)=125,5-35,5-17-13-45=15г/моль, следовательно, радикал в аминокислоте СН3 , а кислота СН3-CH(NH2)-COOH – аланин При реакции этого же пептида с разбавленной соляной кислотой образовался один продукт – соль дипептида NH2-CHR/-CO-NH-CHR//-COOH +HCl → Cl[NH3-CHR/-CO-NH-CHR//-COOH] 16,71% - 35,5 100% - M(соли дипептида), отсюда M(соли дипептида)=212,5 г/моль, тогда М(R//)= M(соли дипептида)-35,5-М(NH3-CHR/-CO-NH-CH-СООН)=212,5-146-35,5=31 г/моль это радикал –CH2–OH, а кислота СН2ОН-CH(NH2) –COOH – серин Т.о. возможные формулы дипептида ала-сер, или сер-ала NH2-CH(СН3)-CO-NH-CH(СН2ОН)-COOH и NH2-CH(СН2ОН)-CO-NH-CH(СН3)-COOH Задача 9. Фуллерен С60 за счет внедрения калия в его кристаллическую решетку образует соединение (интеркалят) с массовой долей калия 14%. При соиспарении фуллерена с цезием и рубидием получается аналогичное соединение, содержащее 67,2% (по массе) углерода. Установите формулы интеркалятов. (4 балла). Решение: КхС60 формула интеркалята, ω(К)=Ar(K)·n/Mr, 0,14=39x/39x+720, x=3 , т.о. К3С60 CsxRbyC60 ω(C)=Ar(C)·n/Mr 0,672=12·60/133x+85y+720, отсюда 133х+85y=351 если х=1, то у=2,569 – не целое число не м.б. если х=2, у=1 – удовлетворяет решению, т.о. формула интеркалята - Cs2RbC60 Задача 10. Массовая доля углерода в углеводороде равна массовой доле водорода. Установите формулу углеводорода (2 балла). Решение: Самая большая (из всех органических веществ) массовая доля водорода - в метане, но она равна 25%. Это наводит на мысль, что речь идет о тяжелых изотопах водорода. Но даже в метане с дейтерием массовая доля водорода меньше 50%. Если предположить, что в состав метана входит изотоп водорода тритий СТ4, то массовая доля углерода становится 50%. Вывод формул органических веществ по продуктам их сгорания или окисления. Задача 1. Решите задачу двумя способами: При сгорании 0,62 г органического вещества получено 0,448 л углекислого газа, 0,224 л азота и 0,9 г воды. Определите формулу вещества, если его относительная плотность по водороду 15,5 (4 балла). Способ I. 1) Найдем М (вещества) = 15,5 ∙ 2 = 31 г/моль 2) Найдем υ(С). υ(С) = υ(СО2) = 0,448/22,4 = 0,02 моль Найдем массу углерода m(C) = υ(С) ∙ М(С) = 0,02 ∙ 12 = 0,24 г 3) Найдем υ(Н). υ(Н) = 2υ(Н2О) = 2∙0,9/18 = 0,1 моль Найдем массу водорода m(Н) = υ(Н) ∙ М(Н) = 0,1 ∙ 1 = 0,1 г 4) Найдем υ(N). υ(N) = 2υ(N2) = 2∙0,224/22,4 = 0,02 моль Найдем массу азота m(N) = υ(N) ∙ М(N) = 0,02 ∙ 14 = 0,28 г 5) Проверим, был ли в исходном веществе кислород: m(O) = m(вещества) – m (C) – m (H) – m (N) = 0,62-0,24-0,1 – 0,28 = 0 г; кислорода в веществе нет. 6) х : y : z = υ(C) : υ(H) :: υ(N) = 0,02 : 0,1 : 0,02 = 1:5:1 СН5N 7) Проверим М(СН5N) = 31 /моль, значит, эта формула истинная. Способ II. 1) Найдем количества всех веществ: υ(вещества) = 0,62/31 = 0,02 моль (М (вещества) = 15,5 ∙ 2 = 31 г/моль) υ(СО2) = 0,448/22,4 = 0,02 моль υ(Н2О) = 0,9/18 = 0,05 моль υ(N2) = 0,224/22,4 = 0,01 моль 2) Составим уравнение реакции в общем виде, расставим коэффициенты перед исходным веществом и продуктами реакции: 2СxНyОzNq + (4х+у-2z)/2О2 = 2хСО2 + у Н2О + qN2 3) Подпишем количества веществ по условию задачи над формулами, количества по уравнению - под формулами: 0,02 0,02 0,05 0,01 2СxНyОzNq +(4х+у-2z)/2 О2 = 2хСО2 + у Н2О + qN2 2 2х у q Из пропорций: 0,02/2 = 0,02/2х; х = 1 0,02/2 = 0,05/у; у = 5 0,02/2 = 0,01/q; q = 1 4) Получилась формула СН5N, ее М = 31 г/моль. Значит, кислорода в веществе нет. Искомая формула СН5N или СН3NH2. Задача 2. При сгорании 2,1 г вещества получено 2,24 л углекислого газа, 0,9 г воды и 0,56 л сернистого газа. Определите молекулярную формулу вещества, предложите его структурную формулу, если известно, что вещество имеет циклическое строение (решите задачу через количества элементов) (3 балла). СxHySzOq 1) Найдем υ(С). υ(С) = υ(СО2) = 2,24/22,4 = 0,1 моль Найдем массу углерода m(C) = υ(С) ∙ М(С) = 0,1 ∙ 12 = 1,2 г 2) Найдем υ(Н). υ(Н) = 2υ(Н2О) = 2∙0,9/18 = 0,1 моль Найдем массу водорода m(Н) = υ(Н) ∙ М(Н) = 0,1 ∙ 1 = 0,1 г 3) Найдем υ(S). υ(S) = υ(SO2) = 0.56/22,4 = 0,025 моль Найдем массу cеры m(S) = υ(S) ∙ М(S) = 0,025 ∙ 32 = 0, 8 г 4) Проверим, был ли в исходном веществе кислород: m(O) = m(вещества) – m (C) – m (H) – m (S) = 2,1-1,2-0,1-0,8 = 0 г; Значит, кислорода в веществе нет. 5) х : y : z = υ(C) : υ(H) : υ(S) : = 0,1 : 0,1 : 0,025 = 4:4:1 С4Н4S 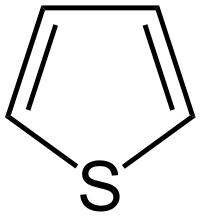 тиофен тиофен Задача 3. При окислении 3,84 г органического вещества получено 2,24 л углекислого газа, 1,8 г воды, 2,12 г карбоната натрия. Определите молекулярную формулу вещества, постройте одну соответствующую структурную формулу (3 балла). 1) Найдем υ1(С). υ(С) = υ(СО2) = 2,24/22,4 = 0,1 моль Найдем υ2(С). υ(С) = υ(Na2СО3) = 2.12/106 = 0,02 моль υ(С) = 0,02 + 0, 1 = 0,12 моль Найдем массу углерода m(C) = υ(С) ∙ М(С) = 0,12 ∙ 12 = 1.44 г 2) Найдем υ(Н). υ(Н) = 2υ(Н2О) = 2∙1.8/18 = 0,2 моль Найдем массу водорода m(Н) = υ(Н) ∙ М(Н) = 0,2 ∙ 1 = 0,2г 3) Найдем υ(Nа). υ(Nа) = 2υ(Nа2СО3) = 2∙2.12/106 = 0,04моль Найдем массу натрия m(Nа) = υ(Nа) ∙ М(Nа) = 0,04 ∙ 23 = 0,92 г 4) Проверим, был ли в исходном веществе кислород: m(O) = m(вещества) – m (C) – m (H) – m (Nа) = 3.84 – 1.44 – 0,2 – 0,92 = 1.28 г; найдем υ(О) = m/M = 1.28/16 = 0,08 моль 5) х : y : z : q = υ(C) : υ(H) : υ(O) : υ(Nа) = 0,12 : 0,2 : 0,08 : 0,04 = 3:5:2:1 С3Н5О2Nа Задача 4. При сгорании 12,9 г органического вещества получено 8,96 л углекислого газа, 7,2 г воды и 4,48 л хлороводорода. Определите молекулярную формулу органического вещества (3 балла). 1) Найдем υ(С). υ(С) = υ(СО2) = 8,96/22,4 = 0,4 моль Найдем массу углерода m(C) = υ(С) ∙ М(С) = 0,4 ∙ 12 = 4,8 г 2) Найдем υ(Н). υ(Н) = 2υ(Н2О) = 2∙7,2/18 = 0,8 моль υ1(Н) = υ(НCl) =4.48/22.4=0.2моль υ(Н) = 0,2+0,8=1 моль Найдем массу водорода m(Н) = υ(Н) ∙ М(Н) = 1 ∙ 1 = 1 г 3) Найдем υ(Сl). υ(Cl) = υ(HCl) = 0,2 моль Найдем массу хлора m(Cl) = υ(Cl) ∙ М(Cl) = 0,2 ∙ 35.5 = 7.1 г 4) Проверим, был ли в исходном веществе кислород: m(O) = m(вещества) – m (C) – m (H) – m (Cl) = 12.9 – 4.8 – 0,8 – 7.1 = 0 г; Значит, кислорода в веществе нет. 5) х : y : z = υ(C) : υ(H) : υ(Cl) : = 0,4 : 1 : 0,2 = 2:5:1 |