Т. М. Мальгина (руководитель группы), директор, к п. н., доцент, заслуженный учитель РФ
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
Самостоятельная деятельность студентов по химии 2.1.Тема 1: Материя. Виды материи. Возможность существования жизни без материи. (2 час) Цель: формирование общих компетенций, которые позволяют создать материалистическое мировоззрение. Методические рекомендации по уровням самостоятельной деятельности студента и задание. Задание первый уровень самостоятельной деятельности: Воспроизведите информацию и ответьте кратко на вопросы. Информация. «Материя и ее движение»[7]. Химия относится к числу естественных наук, изучающих окружающий нас мир со всем богатством его форм и многообразием происходящих в нем явлений. Вся природа, весь мир объективно существуют вне зависимости от сознания человека. Мир материален и все существующее представляет собой различные виды движущейся материи, которая всегда находится в состоянии нёпрерывного движения, изменения, развития. Движение, как постоянное изменение, присуще материи в целом и каждой мельчайшей ее частице. Формы движения материи разнообразны. Нагревание и охлаждение тел, излучение света, электрический ток, химические превращения — все это различные формы движения материи. Одни формы движения материи могут переходить в другие. Так механическое движение переходит в тепловое, тепловое в химическое, химическое в электрическое и т. д. Эти переходы свидетельствуют о единстве и непрерывной связи качественно различных форм движения. При всех разнообразных переходах одних форм движения в другие точно соблюдается основной закон природы — закон вечности материи и ее движения. Этот закон распространяется на все формы ее движения; ни один вид материи и ни одна форма движения не могут быть получены из ничего и превращены в ничто. Это положение подтверждено всем многовековым опытом науки. Отдельные формы движения материи изучаются различными науками: физикой, химией, биологией и другими. Общие же законы развития природы рассматриваются в курсе естествознания. Вопросы: 1. Объясните термин «материя»? 2. О каких формах движения материи вы узнали? 3. Существует ли нематериальный мир? Задание второй уровень самостоятельной деятельности: Выполнить работу по образцу. Студенту необходимо собрать текстовые материалы по теме: «Материя. Виды материи. Возможность существования жизни без материи». Основываясь на собранных текстовых материалах, студенты колледжа составляют рефераты, пишут сочинения по указанной теме. Структура реферата: - обложка (где указывается тема, автор работы, номер группы, текст работы); - содержание (состоит из введения и пунктов, подпунктов или параграфов); - введение, в котором расписываются цели и задачи описываемого материала. - основной текст, где материал делится автором на пункты, подпункты или главы, параграфы, подпараграфы; - выводы; - список литературы (не более 10 источников). Структура сочинения: - введение; - основная часть. В основной части сочинения должно быть рассуждение по теме. Рассуждение опирается на выбранную профессию, то есть каждая тема должна быть профориентирована. Задание третьего уровня самостоятельной деятельности: Моделирование информации. Постройте простейшую словесную материю, описывающую атом, электрон. Зарисуйте эти модели в виде кластера. Предварительно изучите термин «кластер», «граф». Примените эти термины для описания материального мира вашей будущей профессии. Составление проекта. Задание четвертого уровня самостоятельной деятельности: Эвристический уровень – творческое изучение проблемы, создание новых подходов к решению проблем. В соответствии с вашей профессией укажите виды движения материи в вашей профессиональной деятельности. Составьте схемы технологических процессов вашей профессии, где применяются знания о различных формах движения материи. Предполагается проектная деятельность. Предварительно изучите по словарям и поисковым интернет системам термин «технология», «технологическая схема» в различных науках. Задание пятого уровня самостоятельной деятельности: На данном уровне провидится исследование по теме в контексте темы. Провести анализ термина «материя» с философской позиции, естественнонаучной, теологической. Исследование оформить в виде реферата с указанием различных точек зрения на проблему строение материального мира. Литература:
Срок сдачи: две календарные недели после выдачи задания. Средства диагностики проведенной самостоятельной работы: 1. Письменные ответы на вопросы преподавателя. 2. Тесты ЕГЭ для диагностики темы «Материя. Виды материи. Возможность существования жизни без материи»: А1. Число электронов в ионе Са2+ равно
А2. Среди элементов второй группы максимальный радиус атома имеет
A3. Верны ли следующие суждения о кальции и его соединениях? А. Кальций относится к щелочным металлам Б. Оксид кальция относится к амфотерным оксидам
А4. Соединения с ионной связью расположены в ряду:
А5. Электронная конфигурация Is2 соответствует частице
А 6. Среди элементов четвертого периода максимальный радиус атома имеет
А7. Верны ли следующие суждения о железе и его соединениях? А. Железо находится в VIIIA группе. Б. Наиболее типичная степень окисления железа +8.
А8. Веществом с ковалентной полярной связью является
А9. Степень окисления +2, а валентность IV атом углерода имеет в соединении I) СО 3) НСООН 8) С02 4) СН2С12 А10. Ионную кристаллическую решётку имеет
4) бромоводород Таблица 1 – Эталоны ответов:
2.2.Тема 2: «Атомное, молекулярное учение древнего мира о строении материи». (1 час) Цель: формирование общих компетенций у студентов. Познание строения мира в свете атомно-молекулярного учения М.В. Ломоносова. Методические рекомендации. Студенту необходимо собрать текстовые материалы по теме «Атомное, молекулярное учение древнего мира». Текстовые материалы собираются по различным сайтам интернета, которые будут определены современными поисковыми системами. Материал собирается в электронном виде или в виде презентации. Задание первого уровня самостоятельной деятельности: Напишите электронный реферат по теме, опираясь на методические рекомендации; следует обратить внимание студентов на работы русских ученых в области строения материи: М.В. Ломоносова, Д.И. Менделеева, Н.Н. Семёнова. Задание второго уровня самостоятельной деятельности: Создайте презентацию по теме с элементами анализа материала и подготовить текст реферата. Задание третьего уровня самостоятельной деятельности: Оформите материалы электронного реферата и презентации. Подготовьте устный доклад по темам материала. Студент должен уметь рассуждать по данной теме: «Атомное, молекулярное учение древнего мира». Рекомендации по структуре электронного реферата: - обложка (где указывается тема, автор работы, номер группы, текст работы); - содержание (состоит из введения и пунктов, подпунктов или параграфов); - введение, в котором расписываются цели и задачи описываемого материала. - основной текст, где материал делится автором на пункты, подпункты или главы, параграфы, подпараграфы; - выводы; - список литературы (не более 10 источников). Структура презентации: - введение; - основная часть. В основной части должно быть рассуждение по теме, рассуждение опирается на выбранную профессию, то есть каждая тема должна быть профориентирована. Электронный реферат размещается в микроблоге студента. Задание четвертого уровня самостоятельной деятельности: Выпишите основные термины, изученные в теме «Атомно-молекулярное учение». Составьте кроссворд (не менее 20 вопросов). Раздайте данный кроссворд своим товарищам по группе и выявите знания студентов по данной теме. Задание пятого уровня самостоятельной деятельности: Напишите проект (исследование) о роли ученых России в становлении атомно-молекулярного учения. Подберите статьи современных философов, изучающих строение атома и вселенной как философскую категорию. Оформите материал в виде статьи для участия в студенческой конференции. Литература:
Срок сдачи: две календарные недели после выдачи задания. Средства диагностики проведенной самостоятельной работы: 1. Ответы на вопросы преподавателя. 2. Написание ответов на вопросы. 3. Тесты группы А из ЕГЭ (выполняются для самодиагностики): А1. Одинаковую электронную конфигурацию имеют частицы
А2. Наименьшим атомным радиусом обладает
A3. Верны ли следующие суждения об алюминии? А. Атом алюминия в основном состоянии содержит 3 неспаренных электрона. Б. Алюминий образует амфотерный оксид.
Таблица 2 – Эталоны ответов:
2.3.Тема 3 (состоит из трех подтем): «Атом, периодический закон Д.И. Менделеева». 3.1. «Строение атома». 3.2 «Атом – сложная частица». 3.3 «Периодический закон Д.И. Менделеева в свете учения строения атома» (4 час - работа с текстом учебника). Цель: формирование общекультурных компетенций студента. Изучение представленных тем по учебникам, самостоятельный разбор материалов, подготовка заданий с решениями. Методические рекомендации. Студенту необходимо собрать текстовые материалы по темам: 1. «Строение атома и Периодический закон Д.И. Менделеева. Атом – сложная частица» 2. «Ядро (протоны и нейтроны) и электронная оболочка». «Изотопы - в профессиональной деятельности». 3. «Строение электронных оболочек атомов элементов малых периодов. Особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов)». «Понятие об орбиталях. s-, р- и d-орбиталях». Текстовые материалы внимательно прочитываются. При чтении текста учебника по данным темам выписываются незнакомые слова. На компьютере набираются неизвестные термины, далее термины определяются через «вики» интернет системы. Студенты проводят сравнение определений терминов по учебнику и из «вики» энциклопедий. Задание первого уровня самостоятельной деятельности: Прочитайте тексты учебника по перечисленным темам, оформите в тетрадь материал по плану: 1. Выпишите термины и понятия темы. 2. Найдите ключевые выражения из двух слов; 3. Выделите абзацы текста, определите названия. 4. По выделенным абзацам опишите материал темы. 5. Запомните формулы. Найдите логику в формулах. 6. Напишите выводы. При изучении темы «Строение атома и периодический закон Д.И. Менделеева» студентам необходимо обратить особое внимание на огромную теоретическую роль периодического закона при изучении строения атома. В теме «Ядро и электронная оболочка» необходимо выполнить задания: 1) Постройте электронные конфигурации атомов различных групп и периодов. 2) Ответьте на вопрос: «Какие закономерности вы обнаружили в строении электронных оболочек периодов и групп?». Задание второго уровня самостоятельной деятельности: 1) Разберите темы по предложенному плану. 2) Отразите прочитанный материал в виде схем. Вы уже знаете, что состояние электронов можно описать набором четырех квантовых чисел, но для объяснения строения электронных оболочек атомов нужно знать еще три следующих положения: 1) принцип Паули, 2) принцип наименьшей энергии, 3) правила Гунда. Руководствуясь данными принципами и квантовыми числами, выполните задание: 3) Составьте электронные конфигурации атомов 10 химических элементов. Справочный материал [6]: Принцип Паули. В 1925 г. швейцарский физик В. Паули установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Хотя бы одно из квантовых чисел п, L, ml и тs должно обязательно отличаться. Так, электроны с одинаковыми квантовыми числами n, l и ml должны обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми п, I и ml: один с ms = - 1/2, другой с тs = + 1/2.. Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел п, l или тs. Зная принцип Паули, посмотрим теперь, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом п. Первой «орбите» соответствует n=1. Тогда l = 0, ml = 0 и ms может иметь произвольные значения: +1/2 или – 1/2. Мы видим, что, если n = 1, таких электронов может быть только два. В общем случае при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l, принимающим значения от 0 до n-1. При заданных n и l может быть (2L + 1) электронов с разными значениями магнитного квантового числа ml Это число должно быть удвоено, так как заданным значениям n, L и ms соответствуют два разных значения проекции спина. Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т. д. Рассмотрим, например, атом водорода 1Н. В атоме водорода 1Н имеется один электрон, и спин этого электрона может быть направлен произвольно (т. е. ms = +1/2 или ms = - 1/2), и электрон находится в s-состоянии на первом энергетическом уровне с n = 1 (напомним еще раз, что первый энергетический уровень состоит из одного подуровня - 1s, второй энергетический уровень — из двух подуровней - 2s и 2р, третий - из трех подуровней — 3s, Зр, 3d и т. д.). Подуровень, в свою очередь, делится на квантовые ячейки (энергетические состояния, определяемые числом возможных значений ml т. е. 2L + 1). Ячейку принято графически изображать прямоугольником, направление спина электрона — стрелками. Поэтому состояние электрона в атоме водорода 1Н можно представить как 1s1, или, что то же самое, 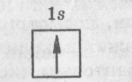 В атоме гелия 2Не квантовые числа n = 1, L = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число тs отличается. Проекции спина электронов гелия могут быть ms = + 1/2 и ms = - 1/2. Строение электронной оболочки атома гелия 2Не можно представить как Is2 или, что то же самое, 1s 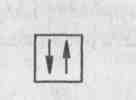 Изобразим строение электронных оболочек пяти атомов элементов второго периода периодической таблицы Менделеева: 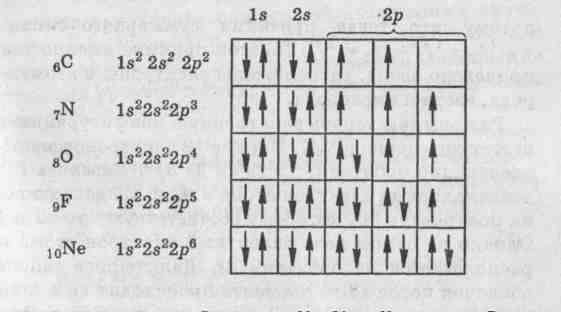 To, что электронные оболочки 6С, 7N и 80 должны быть заполнены именно так, заранее не очевидно. Приведенное расположение спинов определяется так называемым правилом Гунда (впервые сформулировано в 1927 г. немецким физиком Ф. Гундом). Правило Гунда. При данном, значении L (т. е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Если, например, в трех р-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т. е. размещаться на трех разных р-орбиталях: 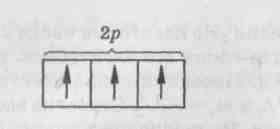 В этом случае суммарный спин равен 3/2, поскольку его проекция равна ms = + - 1/2 + 1/2 + 1/2 = 3/2. Эти же три электрона не могут быть расположены таким образом: 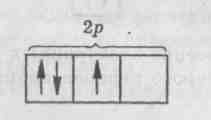 потому что тогда проекция суммарного спина ms =+1/2 –1/2+1/2=1/2. По этой причине именно так, как приведено выше, расположены электроны в атомах углерода, азота и кислорода. Рассмотрим теперь электронную конфигурацию атома четвертого периода 19К. Первые 18 электронов заполняют следующие орбитали: ls22s22p63s23p6. Казалось бы, что девятнадцатый электрон атома калия 19К должен попасть на подуровень 3d, которому соответствуют п = 3 и L = 2. Однако на самом деле валентный электрон атома калия располагается на орбитали 4s. Дальнейшее заполнение оболочек после 18-го элемента происходит не в такой последовательности, как в двух первых периодах. Электроны в атомах располагаются в соответствии с принципом Паули и правилом Гунда, но так, чтобы их энергия была наименьшей. Принцип наименьшей энергии (наибольший вклад в разработку этого принципа внес советский ученый В. М. Клечковский) — в атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей его связи с ядром). Энергия электрона в основном определяется главным квантовым числом п и побочным квантовым числом L, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел п и L является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + L = 4+0 = 4, а во втором n + L = 3 + 2 = 5; на подуровне 5s (п + l = 5 + 0 = 5) энергия меньше, чем на 4d { (п + l = 4 + 2 = 6); на 5р (п + l = 5 + 1 = 6) энергия меньше, чем на 4f (п + l = 4 + 3 = 7) и т. д. Именно В. М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимально возможным значением п, а с наименьшим значением суммы п + l. В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением п. Например, на подуровнях 3d, 4р, 5s сумма значений п и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями п, т. е. 3d-4p-5s и т. д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит в последовательности, которая изображена на рисунке 2. 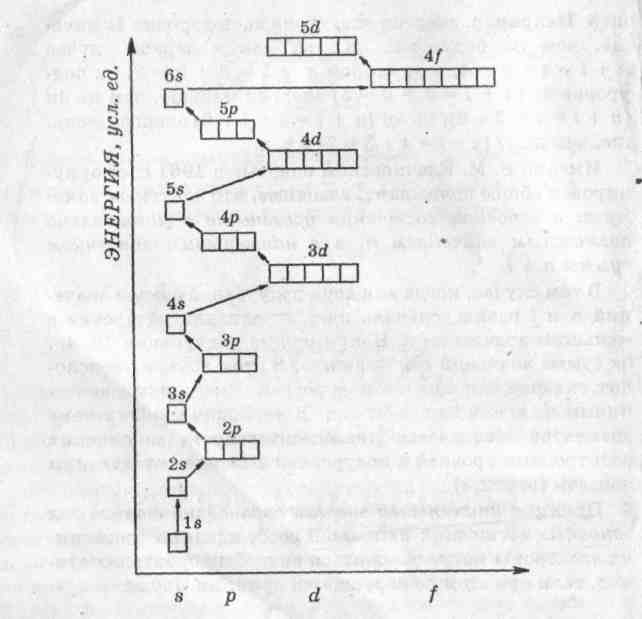 Рисунок 2 – Схема заполнения электронами энергетических уровней и подуровней. Рисунок 2 – Схема заполнения электронами энергетических уровней и подуровней. Принцип наименьшей энергии справедлив только для основных состояний атома. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули. |