Т. М. Мальгина (руководитель группы), директор, к п. н., доцент, заслуженный учитель РФ
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
Задание третьего уровня самостоятельной деятельности: 1) Изучив справочный материал второго уровня самостоятельной деятельности, составьте презентацию, в которой отразите правила заполнения электронами квантовых ячеек атомов. 2) Установите связь строения атома с положением химических элементов в периодической системе Д. И. Менделеева. Задание четвертого уровня самостоятельной деятельности: Известно, что в 1869 году (год открытия периодического закона) информация о строении атома была фрагментарной. 1) Почему после грандиозных физических открытий 20-го века в области строения атома не произошло разрушения периодического закона. В чем гениальность работ Д.И. Менделеева? 2) Объясните, почему существует фраза «Открытие периодического закона сравнимо с открытием новой эры в химии и мировой науке». 3) Напишите сочинение-рассуждение. Задание пятого уровня самостоятельной деятельности: Прочитайте вопросы. По вопросам сформулируйте тему проекта. Тему проекта обсудите с преподавателем. При изучении темы проекта найдите профессиональное применение указанных химических элементов в веществах, которые используются в вашей профессии. Вопросы: 1. Сколько неспаренных электронов содержат невозбужденные атомы В, S, As, Cr? 2. Какие элементы могут проявлять как металлические, так и неметаллические свойства? Приведите не менее трех примеров. 3. Как изменяются неметаллические свойства элементов в периодах периодической системы? Приведите конкретные примеры соединений элементов, подтверждающие эти свойства. 4. В атоме, какого элемента — лития или цезия — связь валентного электрона с ядром сильнее? Объясните почему. 5. Разработка графических схем текстового материала. Литература:
Срок сдачи: одна календарная недели после выдачи задания. Решить тесты группы А: А1. Электронная конфигурация соответствует 1s22s22p2 частице 1) O2- 3) C2+ 2) O2+ 4) C2- А 2. Наименьшим атомным радиусом обладает
A3. Верны ли следующие суждения о цинке и его соединениях? А. Атом цинка в основном состоянии не содержит неспаренных электронов. Б. Цинк образует основный оксид.
А4. Водородная связь реализуется
Таблица 3 – Эталоны ответов:
2.4.Тема 4. «Периодический закон Дмитрия Ивановича Менделеева, свойства веществ». (2 часа) Цель: формирование компетенций в сфере теоретических основ знаний и научно-исследовательской деятельности студента. Методические рекомендации: 1) Студенту необходимо собрать текстовые материалы по теме «Периодический закон Дмитрия Ивановича Менделеева.» 2) Основываясь на собранных текстовых материалах, студенты колледжа составляют рефераты либо пишут сочинения по указанной теме. Задание первого уровня самостоятельной деятельности: Напишите реферат по указанной структуре по теме «Периодический закон Дмитрия Ивановича Менделеева» и подготовьте устное сообщение. Структура реферата: - обложка (где указывается тема, автор работы, номер группы, текст работы); - содержание (состоит из введения и пунктов, подпунктов или параграфов); - введение, в котором расписываются цели и задачи описываемого материала. - основной текст, где материал делится автором на пункты, подпункты или главы, параграфы, подпараграфы. В основной части студентам необходимо рассмотреть вопрос шире, чем он изучается на занятиях. Указать, что периодический закон, открывает новую эру в химии – эру современной химии. Студентам необходимо познакомиться с биографией величайшего химика Д.И. Менделеева. - выводы; - список литературы (не более 10 источников). Структура сочинения: - введение; - основная часть. В основной части должно быть рассуждение по теме. Рассуждение опирается на выбранную профессию, то есть каждая тема должна быть профориентирована. Задание второго уровня самостоятельной деятельности: Напишите полные ответы на вопросы и оформите их в виде реферата: 1. Сколько неспаренных электронов содержат невозбужденные атомы В, S, As, Cr? 2. Какие элементы могут проявлять как металлические, так и неметаллические свойства? Приведите не менее трех примеров. 3. Как изменяются неметаллические свойства элементов в периодах периодической системы? Приведите конкретные примеры соединений элементов, подтверждающие эти свойства. 4. В атоме какого элемента — лития или цезия — связь валентного электрона с ядром сильнее? Объясните почему. 5. Почему в группы лантаноидов и актиноидов входит по 14 элементов? 6. Какие общие свойства имеют элементы Мп и С1, находящиеся в одной группе периодической системы? 7. Каков состав ядер изотопов 12С и 13С, 14N и 15N? 8. Изотоп 210Ро, излучающий а-частицы, используется в смеси с бериллием в нейтронных источниках. Через какое время интенсивность таких источников уменьшится в 32 раза? Период полураспада 210Ро равен 138 дням. 9. Изотоп 137Cs имеет период полураспада 29,7 лет. 1 г этого изотопа прореагировал со взрывом с избытком воды. Каков период полураспада цезия в образовавшемся соединении? Ответ обоснуйте. Задание третьего уровня самостоятельной деятельности: 1) Составьте общую модель – таблицу значения периодического закона Д. И. Менделеева для естествознания в целом и других наук. 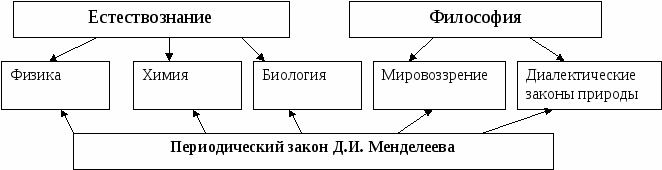 Рисунок 3 – Периодический закон в системе наук естествознания и философии. 2) Опишите, какое значение имеет периодический закон для развития физики, химии, биологии. Материал представьте в виде схемы, которую студент составляет самостоятельно. Задание четвертого уровня самостоятельной деятельности: 1) Пользуясь поисковыми системами интернета, соберите материал о распространенности химических элементов во Вселенной и объясните, какое значение имеет периодический закон для освоения новых миров и планет Вселенной. 2) Материал оформите в виде реферата и презентации, подготовьте сообщение по итогам разработанного материала. Задание пятого уровня самостоятельной деятельности: 1) Самостоятельно изучите тему «Ядро атома и радиоактивные превращения». 2) Ответьте на вопрос: «Существует ли взаимосвязь между темами «Ядро атома и радиоактивные превращения» и «Ядро атома и радиоактивные превращения»?. 3) Напишите примеры ядерных превращений веществ. 4) Объясните значение явления радиоактивности в вашей профессии, где эти вещества могут находиться, откуда мигрировать из окружающей среды. 5) Оформите материал в виде проекта с иллюстрациями и презентацией. Литература:
Срок сдачи: две календарные недели после выдачи задания. Средства диагностики проведенной самостоятельной работы: Выполнение диагностических тестов ЕГЭ из части группы А: А1. Электронная конфигурация ls22s22p6 отвечает
А2. Кислотные свойства в ряду высших оксидов углерода — кремния — фосфора
Таблица 4 - Эталоны ответов:
2.5.Тема 5. «Теория электролитической диссоциации» (1 час) Цель: формирование компетенций в сфере теоретических основ знаний применимых в будущей профессиональной деятельности. Методические рекомендации. Выполнение самостоятельной работы можно проводить в трех направлениях: написание уравнений диссоциации; написание рефератов; написание сочинения или рассказа (профессиональная история), применяя знания по теории электролитической диссоциации. Задание первого уровня самостоятельной деятельности: Напишите уравнения электролитической диссоциации для десяти растворимых солей, которые в водном растворителе диссоциируют на катионы и анионы. Уравнения записываются в тетрадь. Для выполнения задания необходимо прочитать справочный материал к теме. Справочный материал.[6] Электролиты и электролитическая диссоциация Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счет движения электронов в электрическом поле, либо за счет движения ионов. Электронная проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить по их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Оказалось, что, кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давления пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации. Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов. Например, молекула уксусной кислоты может диссоциировать в водном растворе следующим образом: Процесс диссоциации во всех случаях является обратимым, поэтому при написании уравнений реакции диссоциации необходимо применять знак обратимости. Различные электролиты, согласно теории Аррениуса, диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита, его концентрации, природы растворителя, температуры. Сильные и слабые электролиты. Степень диссоциации. Константа диссоциации. Одним из важнейших понятий теории электролитической диссоциации Аррениуса является понятие о степени диссоциации. Степенью диссоциации а называется отношение числа молекул, распавшихся на ионы ( n'), к общему числу растворенных молекул (n): Из этого выражения очевидно, что а может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации часто выражают в процентах. Степень диссоциации электролита может быть определена только экспериментальным путем, например по измерению температуры замерзания раствора, по электропроводности раствора и т. д. В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами. К сильным электролитам относятся почти все соли, некоторые кислоты (НС1, HBr, HI, HN03, HC104, H2S04(paзб.)) и некоторые основания (LiOH, NaOH, КОН, Са(ОН)2, Sr(OH)2, Ba(OH)2). К слабым электролитам относится большинство кислот (особенно органических) и оснований. Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор). Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит. Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде: АК↔ А- +К+. (1) Поскольку диссоциация является обратимым равновесным процессом, то к реакции (1) применим закон действующих масс, и можно определить константу равновесия как K = [A-] [K+] (2) [АК] ' где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита. В таблице 2 представлены численные значения констант равновесия для некоторых химических реакций. Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 10-15. Таблица 2 – Константы равновесий для некоторых реакций электролитов  Например, высокое значение К для реакции Ситв + 2Аg+водн ↔Си2+водн + 2Agr тв (3) означает, что если в раствор, содержащий ионы серебра Ag+, внести металлическую медь, то в момент достижения равновесия концентрация ионов меди [Си2+] намного больше, чем квадрат концентрации ионов серебра [Ag+]2. Напротив, низкое значение К в реакции AgI↔Ag+ + I- (4) говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI. Задание второго уровня самостоятельной деятельности: Основываясь на собранных текстовых справочных материалах, составьте рефераты или напишите сочинение. Структура реферата: - обложка (где указывается тема, автор работы, номер группы, текст работы); - содержание (состоит из введения и пунктов, подпунктов или параграфов); - введение, в котором расписываются цели и задачи описываемого материала. - основной текст, где материал делится автором на пункты, подпункты или главы, параграфы, подпараграфы. В основной части студентам необходимо рассмотреть вопрос шире, чем он изучается на занятиях. Студенты должны внимательно изучить положения теории электролитической диссоциации. На основе этого материла студенты описывают явления диссоциации веществ, которые встречаются в профессиональной деятельности. - выводы; - список литературы (не более 10 источников). Структура сочинения: - введение; - основная часть. В основной части должно быть рассуждение по теме. Рассуждение опирается на выбранную профессию, то есть каждая тема должна быть профориентирована. Задание третьего уровня самостоятельной деятельности: Ответьте на предложенные ниже вопросы в форме реферата, составьте презентацию, подготовьте устное сообщение. Вопросы: 1. Какие вещества называются электролитами? Приведите примеры электролитов? 2. Какие вещества называются неэлектролитами? 3. Какие учёные работали над созданием теории электролитической диссоциации? (особенно обратите внимание на работы русских ученых: Ивана Алексеевича Каблукова, Дмитрия Ивановича Менделеева (теория растворов)). 4. Что означает термин «ассоциация» и «диссоциация»? 5. Сформулируйте и объясните своими словами положения теории электролитической диссоциации? 2. Написание уравнений реакций электролитической диссоциации для веществ: серная кислота (в одну ступень), хлорид магния, соляная кислота. 3.Написание химических рассказов по теме: «Теория электролитической диссоциации». |