| Аналитические исследования Презентация на тему аналитические исследования. gos-fin.ru |
Задача Предложите формулу спирта, молярная масса которого в 2 раза превышает молярную массу самого лёгкого углеводорода (1 балл)
 Скачать 402.16 Kb. Скачать 402.16 Kb.
|
Ответ: диметилоксалат СН3–ООС–СОО–СН3 Предположим, что это был эфир двухатомного спирта этиленгликоля: RCOO-CH2-CH2-OOCR, тогда R=H НCOO-CH2-CH2-OOCН + 2NaOH → НO-CH2-CH2-OН + 2НСООNa НO-CH2-CH2-OН в избытке окислителя в кислой среде окисляется до 2 моль СО2 Следовательно, ответом может быть диформиат этиленгликоля. Задача 5. К одноосновной карбоновой кислоте массой 96 г добавили водный раствор гидроксида бария. Раствор упарили, остаток прокалили при 380оС. В результате прокаливания выделилась смесь газов с плотностью 0,56 г/л и осталось 236,4 г твердого вещества. При добавлении к этому твердому веществу избытка соляной кислоты выделилось 29,04 л газа с плотностью 1,82 г/л при 22оС. Определите состав исходной кислоты. (все измерения проводились при давлении 1 атм) Решение. 1) Проанализируем химизм процесса. Кислота нейтрализуется щелочью, полученная соль прокаливается. Прокаливание солей двухвалентных металлов приводит к образованию кетонов: (RCOO)2Вa → ВaCO3 + R – (C=O) – R В условии сказано, что получена смесь газов. Это говорит о том, что щелочь была в избытке и прошла реакция Дюма: (RCOO)2Вa + Вa(OH)2 → 2ВaCO3 + 2RH Значит, смесь газов состоит из углеводорода и кетона. 2) Используя уравнение Менделеева-Клапейрона, определим молярную массу смеси газов М = mRT/PV; M = ρRT/P; M = 0,56 ∙ 8,314 ∙ (380 + 273)/ 101325 = 0,03 кг/моль = 30 г/моль Такое значение молярной массы показывает, что один газ имеет молярную массу больше 30 (кетон), а другой – меньше 30 (метан, этан имеет массу 30). Отсюда мы делаем вывод, что R = CH3, кетон – это ацетон, а исходная кислота – уксусная. 3) Проверим наше предположение. Определим, в каком соотношении образовались метан (х моль) и ацетон (у моль) 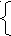  16х +58у = 30 х = 0,667 моль 16х +58у = 30 х = 0,667 мольх + у = 1 моль у = 0,333 моль Определим молярную массу газа, выделившегося при обработке твердого остатка соляной кислотой M = ρRT/P; M = 1,82 ∙ 8,314 ∙ (22+273)/ 101325 = 0,044 кг/моль = 44 г/моль Это углекислый газ Его масса = 1,82 ∙ 29,04 = 52,8528 г, его количество 52,8528 : 44 = 1,2012 моль Это количество равно количеству карбоната бария 236,4/197 = 1,2 моль Количество карбоната, в свою очередь, равно количеству метана (0,667 ∙ 1,2 = 0,8 моль) и ацетона (0,333 ∙ 1,2 = 0,3996 моль) 0,3996 0,3996 0,3996 (RCOO)2Вa → ВaCO3 + R – (C=O) – R 0,4 0,8 0,8 (RCOO)2Вa + Вa(OH)2 → 2ВaCO3 + 2RH Общее количество соли 0,7996 моль, следовательно, кислоты в 2 раза больше: 1,5992 0,7996 2RCOOН + Вa(OH)2 → (RCOO)2Вa + 2Н2О Найдем молярную массу кислоты 96/1,5992= 60 г/моль. Соответствует расчету. Ответ: уксусная кислота Задача 6. Смесь газов, полученная при сжигании 1,8 г образца вещества Х, была пропущена через трубку с пентаоксидом фосфора (ее масса возросла на 2,16 г), потом через склянку с гидроксидом кальция (в ней образовалось 6 г осадка), объем непоглощенного газа У при 35оС и 101,3 Па составил 758 мл. При добавлении к такому же образцу Х избытка азотистой кислоты образуется соединение Z и выделяется вдвое больший объем У, чем при сгорании. Установите строение Х и Z. Решение: 1) пентаоксид фосфора поглощает воду, ее масса 2,16 г; Найдем υ(Н). υ(Н) = 2υ(Н2О) = 2∙2,16/18 = 0,24 моль Найдем массу водорода m(Н) = υ(Н) ∙ М(Н) = 0,24 ∙ 1 = 0,24 г 2) Углекислый газ поглощается известковой водой с образованием карбоната кальция. Найдем υ(С). υ(С) = υ(СаСО3) = 6/100 = 0,06 моль Найдем массу углерода m(C) = υ(С) ∙ М(С) = 0,06 ∙ 12 = 0,72 г 3) Остался азот. Найдем его количество υ(N2) = PV/RT; υ(N2) = 101300 ∙ 0,000758/8,314 ∙ 308=0,03 моль Найдем υ(N). υ(N) = 2υ(N2) = 2∙0,03 = 0,06 моль Найдем массу азота m(N) = υ(N) ∙ М(N) = 0,06 ∙ 14 = 0,84 г 4) Проверим, был ли в исходном веществе кислород: m(O) = m(вещества) – m (C) – m (H) – m (N) = 1,8 – 0,24– 0,72 – 0,84 = 0; кислорода нет 5) х : y : z = υ(C) : υ(H) : υ(N) = 0,06 : 0,24 : 0,06 = 1 : 4 : 1 СН4N – не м.б., удвоим С2Н8N2 Судя по формуле, это предельный диамин. Так как он реагирует с азотистой кислотой с образованием азота, то это первичный амин. 1,2 – диаминоэтан (Х) + 2HNO2 → 2N2 + 2H2O + этиленгликоль (Z) 1,1 – диаминоэтан (Х) + 2HNO2 → 2N2 + 3H2O + уксусный альдегид (Z) Задача 7. Навеску органической соли, состоящей из углерода, кислорода, азота и водорода, массой 10,7 г сожгли в 11,2 л кислорода. Полученная смесь газов была пропущена последовательно через трубку с безводным хлоридом кальция (ее масса увеличилась на 8,1 г), склянку с баритовой водой (выпало 59,1 г осадка) и раскаленную железную трубку (масса увеличилась на 4 г). При этом остался непоглощенным газ с плотностью 1,25 г/л (н.у.). Установите формулу соли. Решение: 1) безводный хлорид кальция поглощает воду, ее масса 8,1 г; υ(Н) = 2υ(Н2О) = 2∙8,1/18 = 0,9 моль m(Н) = υ(Н) ∙ М(Н) = 0,9 ∙ 1 = 0,9 г υ(О) = υ(Н2О) = 8,1/18 = 0,45 моль 2) Углекислый газ поглощается баритовой водой с образованием карбоната бария. υ(С) = υ(ВаСО3) = 59,1/197 = 0,3 моль m(C) = υ(С) ∙ М(С) = 0,3 ∙ 12 = 3,6 г υ(О) = 2υ(СО2) = 2∙ 0,3 = 0,6 моль 3) Масса раскаленной железной трубки увеличилась за счет окисления свободным кислородом, не вступившим в реакцию, υ(О) = 2υ(О2) = 4/16 = 0, 25 моль 4) Остался азот, что определяется по плотности М=1,25·22,4=28 г/моль. 5) По закону сохранения, количество атомов кислорода до и после реакции равны Вступило в реакцию υ(О) = 2υ(О2) = 2∙11,2/22,4 = 1 моль До реакции было (1 + z) моль (О) После реакции стало 0,45 + 0,6 + 0, 25 = 1,3 моль (О) (1 + z) = 1,3 z = 0,3 моль было кислорода в исходном веществе m = 0,3 ∙ 16 = 4,8 г (О) 5) Найдем массу азота 10,7 – 0,9 – 3,6 – 4,8 = 1,4; υ(N) = 1,4 : 14 = 0,1 моль 6) х : y : z : q = υ(C) : υ(H) : υ(O) : υ(N) = 0,3 : 0,9 : 0,3 : 0,1 = 3 : 9 : 3 : 1 С3Н9О3N Ответ: CH3–CH (ОН)–COONH4 или CH2(ОН)–CH2–COONH4 подходит также (НО-СН2-СОО– СН3 NН3+) – соль гликолевой кислоты – гидроксиацетат метиламмония; возможны и другие варианты. Задачи на вывод формул биоорганических молекул Задача 1. При полном гидролизе образца природного жира массой 32 г образовалась смесь четырех продуктов реакции общей массой 34,16 г. Такой же образец жира при полном гидрировании превращается в другой жир, полный гидролиз которого дает всего два продукта. Установите структуру исходного жира. (1999 г) Решение: При гидролизе жира получается смесь трех кислот и глицерин – это четыре продукта. Разница масс продуктов и исходного жира приходится на воду. 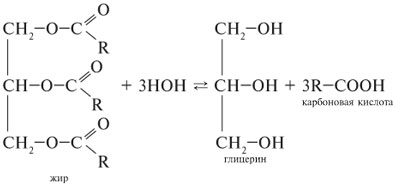 1) Найдем массу воды и ее количество: m = 34,16 – 32= 2,16 г; υ = 2,16 /18 = 0,12 моль 2) Количество жира (в соответствии с уравнением) в 3 раза меньше, чем воды, и равно 0,04 моль 3) Молярная масса жира 32/0,04 = 800 г/моль 4) Определим молярную массу, приходящуюся на три радикала 800 – (44∙3+41) = 627 г/моль 5) Так как после гидрирования жира получается предельный жир, дающий при гидролизе только 2 продукта, в составе кислотных остатков, входивших в первый жир, было одинаковое число атомов углерода. Для определения числа атомов углерода в радикалах трех кислот разделим 627 на 14 (М группы СН2) 627:14 = 44,79. Разделим на 3 ≈ 15 Рассчитаем число атомов водорода в трех радикалах: 627 – 15∙3∙12 = 87 87 = 31 + 29+ 27 Ответ: исходный жир содержал остатки кислот: С15Н31СООН, С15Н29СООН и С15Н27СООН кислот. Задача 2. При нагревании 18 г кислородсодержащего природного вещества Х с избытком аммиачного раствора оксида серебра, получено 32,4 г осадка. При сжигании некоторого количества Х потребовался объем кислорода, равный объему выделившегося при этом углекислого газа. Определите молекулярную формулу Х, приведите структурную формулу, удовлетворяющую условию. Решение: 1) Найдем n(Ag) =32,4/108 =0,3 моль. Вещество Х содержало одну альдегидную группу: RCHO +2[Ag(NH3)2]OH → RCOОNH4 + H2O + 2Ag + 3NH3 n(X) = 1/2n(Ag) = 0,15моль. 2)M(Х) =18/0,15 = 120 г/моль 3) Запишем уравнение реакции горения Х, выразив его формулу как СхНуОz СхНуОz + ((2х+0,5у-z)/2) О2 → хСО2 + 0,5уН2О 4) По условию(2х+0,5у-z)/2 = х Выразим из этого уравнения у: у = 2z 5) Выразим молярную массу Х: 12х + у + 16z = 120, отсюда у = 120 – 12х – 16z 6) Приравняем у: 2z = 120 – 12х – 16z и выразим х через z: х = (120 – 18z)/12 z=0, x=10,y=0 – нет решения z=1, x=8, 5– нет решения z=2, x=7,y=4 – С7Н4О2не хватает водорода z=3, x=5,5 – нет решения z=4, x=4,y=8 – С4Н8О4 искомая формула Так как вещество содержит альдегидную группу и имеет природное происхождение, это углевод–альдотетроза, например, эритроза: 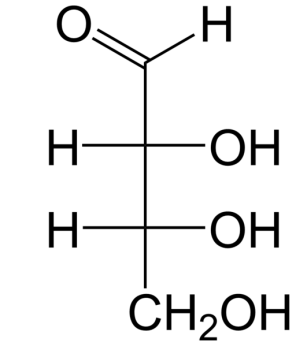 Задача 3. Установите строение природной аминокислоты, если известно, что в результате реакции этой кислоты с этиловым спиртом образуется соединение, молярная масса которого на 18,54% больше молярной массы исходной аминокислоты.(2011 г) Решение
NH2-(CHR)-COOH + C2H5OH → NH2-(CHR)-COOC2H5 + H2O
М(аминокислоты) = (74 + R) М (сложного эфира) = (102 + R)
(74 + R) – 100% (102 + R) - (74 + R) – 18,54% Решаем (74 + R) ∙ 18,54 = (102 + R -74- R) ∙100 1371,96 +18,54R = 2800 18,54R = 1428,04 R= 77 Это радикал фенил. Такой аминокислоты в составе белков нет (фенилглицин), она используется в синтезе красителя индиго. Если при решении правильно определена молярная масса радикала, то задача засчитывалась полностью. Многие пытались подобрать самую близкую по молярной массе аминокислоту (молярная масса аминокислоты равна 74+77=151), что близко к метионину. Это ответ также зачитывался как правильный. Задача 4. Установите строение трипептида, если известно, что число атомов углерода в нем в 2,8 раза больше числа атомов азота и в 3,5 раза больше числа атомов кислорода, при его частичном гидролизе образуются два изомерных дипептида, а для полного гидролиза 1 моль этого трипептида требуется 3 моль гидроксида калия.(2011 г) Решение: Запишем формулу трипептида, исходя из того, что при его гидролизе образуются 2 изомерных дипептида (концевые аминокислоты одинаковые): NH2-(CHR1)-CO NH-(CHR2)-CO NH-(CHR1)-COOH На гидролиз 1 моль трипептида затрачивается 2 моль щелочи + 1 моль – на нейтрализацию концевой карбоксильной группы, итого 3 моль. Следовательно, дополнительно карбоксильных групп или фенольной гидроксильной группы в трипептиде не содержалось. Предположим, что атомов азота в трипептиде было 3, тогда атомов углерода 3∙2,8 = 8,4, а это не соответствует условию, т.к. число не является целым. Предположим, что атомов азота в трипептиде было 4 (в одной аминокислоте была вторая аминогруппа), тогда атомов углерода 4∙2,8 = 11,2, а это не соответствует условию, т.к. число не является целым. Предположим, что атомов азота в трипептиде было 5, тогда атомов углерода 5∙2,8 = 14, а атомов кислорода 14 : 3,5 = 4 В известной части трипептида (см. общую формулу) содержится 6 атомов углерода и 4 атома кислорода, следовательно, в искомых аминокислотах в радикалах должно оказаться 8 атомов углерода и 2 атома азота. Пользуясь таблицей аминокислот, определим R1 – он может содержать аминогруппу, это может быть лизин. При этом радикал аминокислоты лизин содержит 4 углерода. Если трипептид содержит 2 остатка лизина, то на среднюю амнокислоту углеродов не остается, следовательно, это глицин. Ответ: лизилглициллизин или Lys–Gly–Lys   NH2-CH-CO-NH-СН2-CO -NH- CH - COOH NH2-CH-CO-NH-СН2-CO -NH- CH - COOH(СН2)4NH2 (СН2)4NH2 Задача 5. При частичном гидролизе пептида «А», имеющего молярную массу 369 г/моль и содержащего 11,4% азота по массе, получено два пептида «В» и «С». Образец пептида «В» массой 0,624 г может при нагревании вступить в реакцию с 9,43 мл 2,33% раствора гидроксида калия с плотностью 1,02 г/мл. Образец пептида «С» массой 0,888 г полностью реагирует при нагревании с 17,2 мл 0,465 М раствора соляной кислоты. Установите структуру пептида «А». Решение: 1) Определим число атомов азота в пептиде «А». 14n = 369 ∙ 0,114; n = 3. Следовательно, А – трипептид, а В и С – дипептиды 2) Определим количество KOH; υ = ρVω /M= 1,02٠9,43٠0,0233/56 = 0,004 моль На гидролиз дипептида затрачивается 2 моль щелочи, следовательно, количество дипептида В 0,002 моль, а его молярная масса 0,624:0,002 = 312 г/моль 3) Определим количество НCl; υ =VC = 0,0172 ∙0,465 = 0,008 моль На гидролиз дипептида затрачивается 2 моль кислоты, следовательно, количество дипептида С 0,04 моль, а его молярная масса 0,888:0,004 = 222 г/моль 4) Добавляя молярную массу воды к молярным массам пептидов, получим суммы молярных масс аминокислот Х, У и Z, входивших в пептиды. M  (X+Y+Z) = 369 + 36 = 405; (X+Y+Z) = 369 + 36 = 405; M(X+Y) = 312 +18 = 330; M(Y+Z) = 222 + 18 = 240; выразим X и Z из 2-го и 3-го уравнений и подставим в первое. У = 165 – это фенилаланин, тогда Х = 330 – 165 = 165, тоже фенилаланин, Z = 240 – 165 = 75 – глицин Ответ: фен-фен-гли или гли-фен-фен Задача 6. При обработке продуктов гидролиза 3,63 г нуклеотида, содержащего 19,28% азота по массе, избытком известковой воды, выпало 1,55 г осадка. Установите структурную формулу нуклеотида.(2006 г) Решение: 1) При гидролизе нуклеотида образуется углевод, азотистое основание и фосфорная кислота, которая и дает осадок с избытком известковой воды: 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O Определим количество фосфата кальция: 1,55 : 310 = 0,005 моль Количество кислоты в 2 раза больше – 0,01 моль 2) Количество нуклеотида 0,01моль, тогда его молярная масса 3,63 : 0,01 = 363 г/моль 3) Определим число атомов азота в нуклеотиде 14 n = 363 ∙ 0,1928 = 5. 5 атомов азота содержится в аденине и гуанине. 4) Подберем формулу нуклеотида. М(нуклеотида) = М(H3PO4) + М(углевода) + М(азотистого основания) – 2М (Н2О) Предположим, азотистое основание – аденин: 363 = 98 + 135 + М(углевода) – 36 М(углевода) = 166 г/моль – решения нет Предположим, азотистое основание – гуанин: 363 = 98 + 151 + М(углевода) – 36 М(углевода) = 150 г/моль – это рибоза Ответ: рибогуанозинфосфат Решение заданий зачета
Решение: Составим формулу моноаминомонокарбоновой кислоты в общем виде: СnH2n+1O2N Выразим молярную массу кислоты: М=14n+47 Рассчитаем молярную массу кислоты по массовой доле атомов кислорода: 32/0,3595=89 Приравняем молярные массы, найдем n: 14n+47=89 n=3 С3H7O2N – это может быть аланин или 3-аминопропановая кислота
Решение: Пусть спирт был одноатомный, а кислота одноосновная, тогда на 1 моль эфира потребуется 1 моль гидроксида натрия. n (NаОН)= 10∙0,1/40=0,025 моль n (СnH2nO2)=0,025 моль, М (СnH2nO2)=1,85/0,025=74 г/моль Выразим молярную массу эфира: М=14n+32 Приравняем молярные массы, найдем n: 14n+32=74 n=3 С3H6O2 Варианты сложного эфира: метилацетат 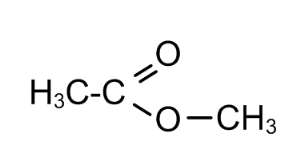 Этилформиат 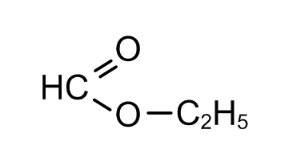
Решение: Найдем количества вещества продуктов горения, по ним определим массы атомов углерода, водорода и азота: υ (С) = υ (СО2) =1,792/22,4 = 0,08 m(С) =0,96г υ (Н) = 2υ (Н2О) =2∙1,62/18 = 0,18 m(Н) =0,18 г υ (N) = 2υ (N2) =2∙0,224/22,4 = 0,02 m(N)=0,28 г Определим наличие кислорода в исходном веществе: 2,06-(0,96+1,18+0,28)=0,64 г приходится на кислород υ (О)=0,64/16=0,04 моль определим формулу вещества: υ (С) : υ (Н) : υ (N) : υ (О) = 0,08 : 0,18 : 0,02 : 0,04 = 4:9:1:2 С4Н9 NО2
Решение: 1) При окислении аренов углекислый газ образуется из метильных радикалов, соединенных с первым от бензольного кольца углеродом. Рассчитаем количество углекислого газа по уравнению Менделеева-Клапейрона: υ = PV/PT = 101325 Па∙ 0,0171 м3/8,314 ∙298К = 0,7 моль 2) Рассчитаем количества бензойной (24,4/122 = 0,2 моль) и фталевой (49,8/166 = 0,3 моль) кислот 3) Наличие в продуктах окисления бензойной кислоты говорит о том, что один из исходных углеводородов имел одну боковую цепь, наличие фталевой кислоты – о том, что второй углеводород содержал две боковые цепи. Отсутствие в продуктах других органических продуктов говорит о том, что в боковых цепях с первым от кольца углеродом были соединены только метильные радикалы. 4) Сопоставляя количество углекислого газа и карбоновых кислот, можно прийти к выводу, что арен с одной боковой цепью количеством 0,2 моль дал 0,4 моль СО2 (значит, в боковой цепи было два метильных радикала), а арен с двумя боковыми цепями – 0,3 моль СО2 (значит, в его боковой цепи был один метильный радикал), всего 0,7 моль СО2. Ответ: изопропилбензол (кумол) и орто-метилэтилбензол
|