Цель: по экспериментальным данным установить зависимость скорости реакции от концентрации реагирующих веществ. Способы действий
 Скачать 113.58 Kb. Скачать 113.58 Kb.
|
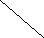   Цель: по экспериментальным данным установить зависимость скорости реакции от концентрации реагирующих веществ. Цель: по экспериментальным данным установить зависимость скорости реакции от концентрации реагирующих веществ. Способы действий: наблюдение за ходом демонстрационного эксперимента, математические расчеты, решение задач. Планируемый результат: учащиеся устанавливают соответствие экспериментальных данных основному закону кинетики, применяют закон действующих масс в решении расчетных задач. Цели урока: Образовательные: расширить представления учащихся о скорости химических реакций; уяснить сущность закона действующих масс (ЗДМ); экспериментально исследовать зависимость скорости химической реакции от концентрации реагирующих веществ. Развивающие: продолжить формирование экспериментальных навыков учащихся; развивать умение работать в группах и индивидуально; продолжить формирование химического мышления, развития речи, памяти, познавательного интереса к предмету, самостоятельности, умения делать выводы. Воспитательные: воспитывать умение работать в паре, коммуникативные умения. Урок «Зависимость скорости химической реакции от концентрации реагирующих веществ» Вступительное слово учителя: Возможность протекания химической реакции не означает, что мы наблюдаем ее признаки в реальных условиях. Так, горючее вещество – уголь – может в природе образовывать большие месторождения и длительное время сохраняться в неизменном состоянии. Но если уголь поджечь, он горит, выделяя большое количество энергии, а угольная пыль в шахтах иногда взрывается. Одна из особенностей химической реакции заключается в том, что они протекают во времени. Одной реакции требуется для завершения микросекунды, другой – миллионы лет. Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома. Долька яблока уже через несколько минут покрывается бурой пленкой; петарда, брошенная в костер, оглушительно взрывается. Интересно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости. Какие условия необходимы для протекания химической реакции, как много времени требуется для полного превращения исходных веществ в продукты реакции, какие факторы влияют на скорость химических изменений? Все эти вопросы изучает раздел химии, называемый химической кинетикой. - Что называется скоростью химической реакции? - Какие реакции называют: а) гомогенными? б) гетерогенными? Приведите примеры таких реакций. - Дайте понятие скорости гомогенной реакции. - Дайте понятие скорости гетерогенной реакции. Важно не только знать скорость химической реакции, но и научиться ею управлять. Зачем? Чтобы ускорить нужную реакцию и замедлить нежелательную. Как сказал Гете: “Просто знать – еще не все, знания нужно использовать”. - Какие факторы влияют на скорость химических реакций? На этом уроке экспериментально исследуем влияние концентрации веществ на скорость химических процессов. Зависимость скорости химической реакции от концентрации реагирующих веществ можно проследить по взаимодействию растворов тиосульфата натрия и серной кислоты.. Немного о тиосульфате натрия: химическая формула – Na2S2O3, широко используется в медицине. В фотоделе он известен под названием фиксажной соли. Обработанные им пленки и тщательно промытые водой, становятся нечувствительными к дальнейшему действию света. Смысл химической реакции, лежащей в основе эксперимента: при взаимодействии тиосульфата натрия с серной кислотой наблюдается помутнение - появление чистой серы (признак химической реакции). Эта реакция идет в две стадии. Запишем уравнения реакций, которые здесь протекают: I стадия: Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3 (мгновенно) II стадия: Н2S2O3= H2O + SO2↑ + S↓ (медленно) Первая реакция протекает практически мгновенно. Образовавшаяся слабая тиосерная кислота – вещество неустойчивое и медленно разлагается с образованием коллоидной серы. Сера – нерастворимое в воде вещество, вот почему выпадает осадок. В этом случае скорость измеряется временем от начала сливания растворов до появления во всех опытах одинаковой плотности суспензии серы. Для эксперимента берем 0,1 М раствор тиосульфата натрия. Изменять его концентрацию будем при помощи воды. Концентрация серной кислоты останется без изменений. Что считать временем начала реакции? Момент сливания растворов тиосульфата натрия, воды и серной кислоты считаем нулевым, далее вы отсчитываете время до появления помутнения. Чтобы лучше увидеть образование серы в реакции, используйте черную бумагу. Проведем эксперимент. Демонстрационный эксперимент: В три стакана одинакового диаметра наливаю: в первую – 50 мл 0,1М раствора тиосульфата натрия и 100 мл дистиллированной воды; во второй – 100 мл раствора тиосульфата натрия и 50 мл воды; в третий – 150 мл раствора тиосульфата натрия. В три другие стакана наливаю по 50 мл 1М раствора серной кислоты. Температура растворов одинаковая. Сейчас я смешаю содержимое двух стаканов. Мы отметим время, в течение которого появляется помутнение после приливания кислоты. На стенки наших стаканов приклеена черная полоска, когда она перестанет быть различима – это и будет временем нашей реакции. Результаты эксперимента запишем в таблицу.
Вычислим концентрации тиосульфата натрия в стаканах. - Какую концентрацию обозначают С? (молярную) - Что она показывает? (отношение числа молей вещества к объему раствора) С = 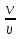 ; раствор был 0,1М, т.е. в 1 л раствора содержалось 0,1 моль тиосульфата натрия; ; раствор был 0,1М, т.е. в 1 л раствора содержалось 0,1 моль тиосульфата натрия;в 1 л раствора - 0,1 моль тиосульфата натрия; тогда в 0,05 л - 0,005 моль тиосульфата натрия; С1 = 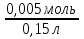 = 0,03(3) моль/л = 0,03(3) моль/лв 1 л раствора - 0,1 моль тиосульфата натрия; тогда в 0,1 л - 0,01 моль тиосульфата натрия; С2 = 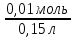 = 0,06(6) моль/л = 0,06(6) моль/лв 1 л раствора - 0,1 моль тиосульфата натрия; тогда в 0,15 л - 0,015 моль тиосульфата натрия; С3 = 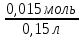 = 0,1моль/л = 0,1моль/л Заносим результаты вычислений в таблицу. Вывод: Концентрация Na2S2O3 от опыта 1 к опыту 3 увеличивается, а время реакции наоборот уменьшается. Следовательно, скорость химической реакции обратно пропорциональна времени ее протекания. Вычисляем скорость реакций: υ = 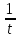 υ1 = 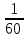 = 0,016(6) = 0,016(6)υ2 = 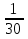 = 0,03(3) = 0,03(3)υ3 = 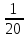 = 0,05 = 0,05Результат записываем в таблицу. Очевиден вывод, чем выше концентрация реагирующих веществ, тем больше скорость химической реакции. Необходимым условием того, чтобы между частицами исходных веществ произошло химическое взаимодействие, является столкновение их друг с другом. Чем больше число столкновений, тем быстрее идет реакция. А число столкновений зависит от концентрации веществ. На основе большого экспериментального материала был сформулирован закон действующих масс. Закон действующих масс: Скорость химической реакции прямопропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов. Для реакции: а А + b B = с С υ = k • СА а • СB b, где k – константа скорости, постоянная величина для данной реакции. Запишем формулу для вычисления скорости реакции, пользуясь законом действующих масс. υ = k • С(Na2S2O3) • С(Н2SO4) 1-й ряд вычисляет скорость реакции в стакане №1, 2-ой ряд – в стакане №2, 3-ий – в стакане №3. Три ученика записывают результат на доске: υ1 = k • 0,03(3) • 0,1 υ2 = k • 0,06(6) • 0,1 υ3 = k • 0,1 • 0,1 Для того, чтобы определить во сколько раз увеличится скорость реакции в опыте 2 по сравнению с опытом 1, находим отношение: 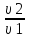 = = 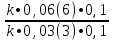 = 2 = 2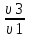 = = 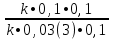 = 3 = 3Математические расчеты полностью повторяют экспериментальные данные. Т.к. скорость реакции обратно пропорциональна времени ее протекания, можно вычислить и время реакции в каждом случае: 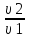 = 2; υ2 = 1 / t2; υ1 = 1 / t1 ; то = 2; υ2 = 1 / t2; υ1 = 1 / t1 ; то 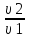 = = 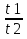 ; 60 / t2 = 2; t2 = 30 ; 60 / t2 = 2; t2 = 30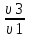 = 3; υ3 = 1 / t3; υ1 = 1 / t1 ; то = 3; υ3 = 1 / t3; υ1 = 1 / t1 ; то 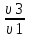 = = 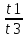 ; 60 / t3 = 3; t3 = 20 ; 60 / t3 = 3; t3 = 20Рассмотрим еще один пример влияния концентрации реагирующих веществ на скорость химической реакции на примере реакции взаимодействия органической уксусной кислоты с металлическим цинком. Запишем уравнение реакции: 2 СН3СООН + Zn → Zn(СН3СОО)2 + Н2↑ 2 Н + + Zn → Zn 2+ + Н2↑ Проведем лабораторный опыт. Лабораторный эксперимент 2. В пробирку с 75%-ным раствором уксусной кислоты помещаем несколько гранул цинка. Отметим слабое выделение пузырьков газа водорода. Теперь добавляем в пробирку с реакционной смесью воду из второй пробирки. Убеждаемся, что с повышением концентрации скорость реакции будет уменьшаться (скорость реакции определяем по числу пузырьков водорода). Zn 10 мл 75%-ной СН3СООН Скорость реакции зависит от концентрации кислоты. Чем больше концентрация, тем меньше скорость реакции. Почему? СН3СООН ↔ СН3СОО - + Н + С увеличением концентрации активность кислоты уменьшается. У слабых электролитов степень диссоциации увеличивается с разбавлением (увеличивается концентрация ионов Н+). Закрепление: Решите задачи:
Концентрацию вещества А увеличили с 0,03 моль/л до 0,09 моль/л. Концентрация вещества В, равная 0,02 моль/л не изменилась. Во сколько раз увеличилась скорость реакции? υ = k • СА а • СB b υ1 = k • 0,03 • 0,02 = k • 6•10 -4 υ2 = k • 0,09 • 0,02 = k • 18•10 -4 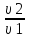 = = 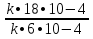 = 3 = 3Ответ: скорость реакции увеличилась в 3 раза.
Концентрацию вещества Н2 увеличили с 0,01 моль/л до 0,03 моль/л. Концентрацию вещества Br2 увеличили с 0,03 до 0,06 моль/л. Во сколько раз увеличилась скорость реакции? υ = k • С(Н2) • С(Br2) υ1 = k • 0,01 • 0,03 = k • 3•10 -4 υ2 = k • 0,03 • 0,06 = k • 18•10 -4 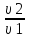 = = 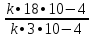 = 6 = 6Ответ: скорость реакции увеличилась в 6 раза.
Решение: А – пероксид водорода медленно разлагается с образованием воды и молекулярного кислорода: 2 Н2О2 → 2 Н2О + О2↑ В – С1(Н2О2) = 0,3 моль/л; С2(Н2О2) = 0,15 моль/л;  t = 30 дней t = 30 днейυ = 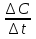 = = 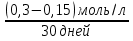 = 0,005 моль•л/день = 0,005 моль•л/деньОтвет: υ = 0,005 моль•л/день | ||||||||||||||||||||||||||||||||||
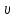 =
=